时间:2025-06-25 21:20:33
1、选择题 汽车的启动电源常用铅蓄电池,放电时其电池反应如下:PbO2+Pb+2H2SO4="=" 2PbSO4+2H2O。根据此反应判断,下列叙述中正确的是
A.Pb是正极
B.PbO2得电子,被氧化
C.负极反应是Pb+SO42——2e—="=" PbSO4
D.电池放电时,溶液酸性增强
2、选择题 有一种钮扣微型电池,其电极分别为Ag2O和Zn电解质溶液是KOH溶液,俗称银锌电池,该电池的电极反应式为:Zn+2OH--2e==ZnO+H2OAg2O+H2O+2e==2Ag+2OH-根据以上提供的资料,判断下列说法正确的是
①锌为负极,Ag2OO正极;
②放电时正极附近溶液的PH值升高;
③放电时负极附近溶液的PH值升高;
④溶液中阳离子向正极方向移动,阴离子向负极方向移动.
A.都正确
B.只有①②
C.①②③
D.①②④
3、填空题 依据氧化还原反应:2Ag+(aq)+Fe(s)?=Fe2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题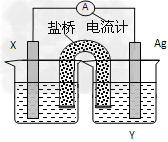
(1)电极X的材料是________;电解质溶液Y是__________;
(2)银电极为电池的__________极;X电极上发生的电极反应为___________;
(3)盐桥中的阳离子移动的方向是________(移向X或移向Y)。
4、填空题 I.已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)?△H=+140kJ·mol-1
2C(s)+O2(g)=2CO(g)?△H=-221kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:?。
II.将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
则可以判断该分解反应已经达到平衡状态的是?。
A.2v正(NH3)=v逆(CO2)? B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变? D.密闭容器中氨气的体积分数不变
III.以丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐。电池的一极通入O2和CO2,电极反应式为:O2+2CO2+4e-=2CO32-;另一极通入丙烷,电极反应式为?;放电时,CO32-移向电池的?(填“正”或“负”)极。
IV.如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和物质的量浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。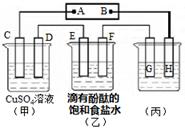
⑴若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为?。
⑵现用丙装置作“铜的电解精炼”,则H应该是?。(填“纯铜”或“粗铜”)。
⑶上图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则乙装置中,若不考虑Cl2的溶解及与碱的反应,此装置共产生气体?L(标准状况)。
5、选择题 等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
A.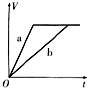
B.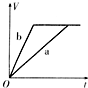
C.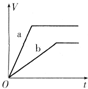
D.