时间:2025-06-25 21:19:44
1、填空题 (1)上表中的实线是元素周期表部分边界,请在表中用实线画出金属元素的边界(实线内的元素全是金属元素)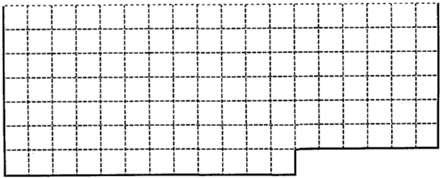
(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等非金属元素组成的离子化合物写出其化学式______,
(3)元素乙是第三周期原子半径最小的金属元素,丙是短周期元素中原子半径最大的元素,用电子式表示丙在空气中加热反应生成B的形成过程______.B中含有的化学键是______
(4)化合物C是由甲元素和乙元素形成的化合物,将化合物A与化合物C等物质的量溶于水中,向其中滴加过量的2mol?L-1氢氧化钠溶液,直至形成透明溶液.请根据实验现象出现的先后顺序,依次写出离子方程式:__________________.
(5)实验中丙元素的鉴别方法______(不写过程)与现象______.
2、选择题 下列叙述中错误的是
A.原子半径Na>Si>Cl
B.金属性Na>Mg>Al
C.稳定性SiH4<HCl<H2S
D.酸性H3PO4<H2SO4<HClO4
3、推断题 已知A、B、C、D、E都是周期表中短周期的主族元素,它们的原子序数依次增大。A原子的最外层电子数是次外层的2倍,B、D的氧化物是导致酸雨的主要物质,C元素在短周期元素中第一电离能最小(下列涉及A、B、C、D、E请用元素符号填充)。
(1)D、E元素电负性大小关系为__________。
(2)B、D的氢化物的分子空间构型分别为__________、__________。
(3)根据等电子理论可知,A的某种氧化物(AO)的结构式为__________。
(4)相对分子质量为28的A的氢化物分子中,A原子杂化类型为__________,分子中σ键与π键数目之比为__________。
(5)C与E形成的晶体,其结构如图所示。晶体中离子的配位数(即与一种离子周围紧邻的带相反电荷的离子数目)为__________,一个晶胞中C离子数目为__________个。 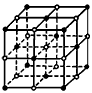
4、选择题 若原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第二层电子数不超过15个,而且各电子层容纳电子数最多为2n2个,则元素周期表中第3、4、5周期含有的元素分别有
[? ]
A.5种、10种、15种
B.8种、18种、18种
C.8种、10种、15种
D.9种、10种、15种
5、选择题 根据元素的单质和化合物性质判断元素非金属性强弱的依据一般是( )
A.元素最高价氧化物的水化物的碱性强弱
B.元素氧化物的水化物的酸性强弱
C.元素单质跟酸反应置换出氢的难易
D.元素的单质跟氢气生成气态氢化物的难易