时间:2025-06-25 21:13:08
1、选择题 实验室用铅蓄电池作电源电解水,已知铅蓄电池放电时的电极反应如下:
负极:Pb + SO42
2、填空题 (9分) 观察下列几个装置示意图,有关叙述正确的是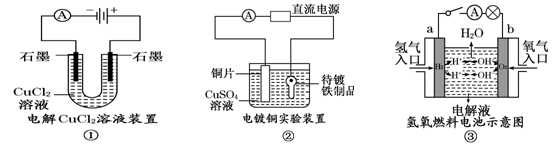
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
3、选择题 氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液。电极反应如下:
2H?2 +4OH--4e- = 4H2O?,? O2+2H2O+4e- = 4OH-
据此作出判断,下列说法中错误的是
A.O2在正极发生还原反应
B.电池总反应为2H2 + O2 = 2H2O
C.反应时负极附近c(OH-)增大
D.氢氧燃料电池属于环境友好电池
4、选择题 某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是
[? ]
A? 放电时,LiMn2O4发生氧化反应
B? 放电时,正极反应为:Li++LiMn2O4+e-=Li2Mn2O4
C 充电时,LiMn2O4发生氧化反应
D 充电时,阳极反应为:Li++e-=Li
5、选择题 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是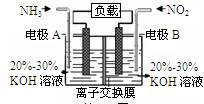
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol