时间:2021-06-11 07:16:12
1、实验题 (1)中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次。请你评价若用上述方法制取乙醛存在哪些不足
____________________________(写出两点)
某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。填写下列空白?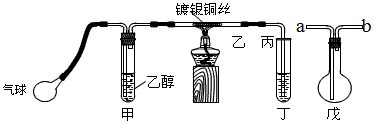
(2)甲装置常常浸在70~80℃ 的水浴中,目的是________________________。
(3)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为____________________________。
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接___________、___________接丙。
2、实验题 .利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
(A)?(B)?(C)?
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
①?、②?、③?、④?、⑤?、⑥?、⑦?.
(2)实验中使用了空气,其作用是?;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量?(填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是?,若缺乏干燥管Ⅱ,其后果是?.
(4)若分液漏斗中④的滴液速度过快,将导致实验结果?(填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为?。
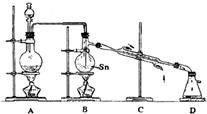
3、简答题 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为:______,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为______.
第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,右图是制取SnCl4的实验装置.
试回答以下问题:
(1)装置A中反应的化学方程式为______;
(2)当反应生成SnCl4时,应熄灭______处的酒精灯,理由是______;
(3)装置B的主要缺点是______,装置D的主要缺点是______;
(4)即使装置B和装置D进行改进后,老师说该实验装置设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称)并在下边方框中画出.
4、实验题 (6分)为了验证浓H2SO4和木炭在加热时发生反应生成的各种产物,甲、乙两学生分别设计如下实验方案:(图中→表示气体流向)
(1)上述方案可达到实验目的的是______________(填“甲”或“乙”)。
(2)具体说明能达到实验目的的方案中,气体通过的各装置(用字母表示)的作用:?。
5、实验题 (1)浓硫酸与木炭粉在加热条件下的化学方程式为___________________。
(2)已知KMnO4酸性溶液可以吸收SO2,试用下图中各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号): __________→___________→_________→________。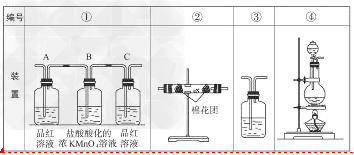
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______________,B瓶溶液的作用是__________,C瓶溶液的作用是______________。
(4)装置②中所加的固体药品是________,可确证的产物是,确定装置②在整套装置中位置的理由是________________________。
(5)装置③中所盛溶液是_______________,可验证的产物是_____________。?