时间:2021-06-11 07:16:12
1、实验题 (10分) 无水CuSO4在强热下会发生分解反应:
CuSO4 CuO + SO3↑
CuO + SO3↑
2SO3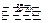 2
2 SO2↑+ O2↑
SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。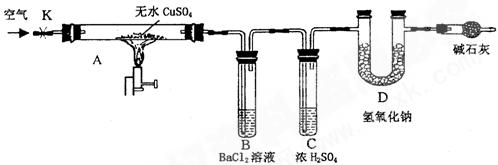
实验步骤:
①称量反应前D 管的质量。
管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热 。
。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是__________________________________________________。
有关离子方程式是__________________________________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是______________________
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是__________________________________________________________。
参考答案:(1)有气泡冒出,产生白色沉淀,且明显放热(2分)
SO3 + H2O + Ba2+= BaSO4↓+ 2H+
或SO3 + H2O = 2H++SO42-, SO42- + Ba2+= BaSO4↓(4分)
(2) SO3溶于水放热(2分)
(3)不能(2分),SO3不能完全分解为SO2和O2, 且部分SO2会溶解在溶液中(4分)
本题解析:略
本题难度:简单
2、实验题 (16分)文献资料显示某地区的酸雨主要为硫酸型和盐酸型酸雨。某兴趣小组对酸雨进行实验研究。
(1)提出合理的假设:该酸雨中的溶质除H2SO4、HC1外,该小组同学根据硫酸型酸雨的形成过程,预测主要溶质还一定有?。
(2)设计实验方案验证以上假设。在答题卡上写出实验步骤、预期现象和结论。
限选试剂及义器:盐酸、硝酸、BaC12溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。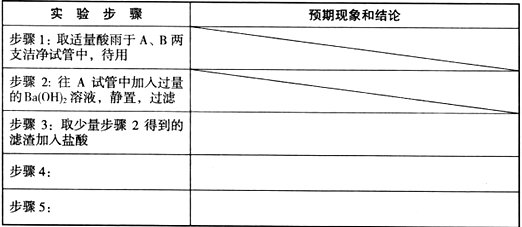
(3)酸雨部分组成测定:
①滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴淀粉溶液,将0.02000mol·L—1 碘水装入50mL酸式滴定管,滴定终点现象为?,记录数据,重复滴定2次,平均消耗碘水VmL。
②计算:被碘水氧化的物质的物质的量浓度之和为?(只列出算式,不做运算)
参考答案:(16分)
(1)SO2(或H2SO3)
(2)每空2分
实验步骤
预期现象和结论
步骤3:
若滤渣不完全溶解,则酸雨中含硫酸
步骤4:取适量步骤2得到的滤液,先加入过量的硝酸,然后加入AgNO3溶液
若产生白色沉淀,则酸雨中含盐酸
步骤5:往B试管中加入少量品红溶液,振荡
若品红溶液褪色,则酸雨中含亚硫酸或SO2
(3)
①溶液出现蓝色,且半分钟不褪色
②0.02V/25mol/L
本题解析:(1)硫酸型酸雨,SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4;形成过程中可能产生SO2、H2SO3;
(2)设计实验验证(1)中的假设,含H2SO4、HC1、SO2、H2SO3;检验C1-:加硝酸酸化的硝酸银溶液,产生白色沉淀;检验SO2,用品红溶液;检验SO42-,用Ba2+;
(3)H2SO3+I2+H2O=2HI+H2SO4;H2SO3和I2为1:1反应;
本题难度:一般
3、实验题 某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
(1)用下列实验装置制取干燥纯净的氯气?
①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为______________(填仪器接口的字母编号)
②该实验还存在不足之处,应如何改进?_________________________
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:____________;假设③:_____________。
②设计实验方案:取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
由此得出结论:假设_____________成立(填序号①②③)。
(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是_____________(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
(4)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜。该过程中甲池负极的电极反应式是____________,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为?_______________(假设气体全部逸出)。 
参考答案:(1)①aedbcgf? ;②在C后接NaOH溶液尾气处理装置
(2)(1)FeCl2;FeCl3和FeCl2的混合物
由此得出结论:假设?①?结论成立
(3)A?D
(4) ;1.12L
;1.12L
本题解析:
本题难度:一般
4、填空题 (9分)(1)某实验需要用1.0mol·L-1 NaOH 溶液450mL。配制该溶液所需要的玻璃仪器有?;
(2)配制实验操作步骤有:a.在天平上称量?g NaOH固体放入烧杯中,加水溶解,冷却至室温。b.把制得的溶液小心地注入一定容积容量瓶中。c.继续向容量瓶中加水至距刻度线1cm~2cm处,改用胶头滴管加水至刻度线。d.用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀。e.将容量瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为? ?。
?。
②该配制过程中两次用到玻璃棒,其作用分别是?、? ?。
?。
③定容时,若俯视凹液面,会使结果?(填“偏高”、“偏低”或“无影响”)
④若没有进行d步操作,会使结果?(填“偏高”、“偏低”或“无影响”)
⑤在进行b步操作时,不慎有液体溅出,下列处理措施正确的是(?)
A.继续进行实验
B.添加部分NaOH溶液
C.倒掉溶液,重新配制
D.倒掉溶液,洗净容量瓶后重新配制
参考答案:(9份)(1)500mL 容量瓶 烧杯 玻璃棒 胶头滴管 (2分)
(2)(每空1分)20.0 ① a b dc e ②搅拌加速溶解 引流 ③偏高 偏低 D
本题解析:略
本题难度:一般
5、计算题 (1)某学习小组利用下图装置制取氯气并探究其性质。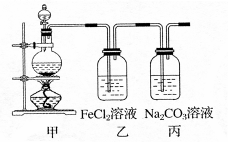
①甲装置中反应的化学方程式是?;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)?;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是?。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含?;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管? ? ? | 若无气体放出且澄清石灰水未见浑浊,则假设一成立;? ? ? |
| ② | ? ? ? | ? ? ? |
参考答案:(14分)
(1)①MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O (2分)
MnCl2+ Cl2↑+2H2O (2分)
②KSCN溶液(1分);溶液变红色(1分)[或NaOH溶液,红褐色沉淀等合理答案均给分];
③Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3(2分)
(2)CaCO3、CaCl2(2分)
(3)10-8/(a-0.1) (2分)
实验步骤
预期现象和结论
①
加入适量1mol/L-1盐酸(1分),塞上带导管的单孔塞,将导管另一端插入A试管中(1分)
若有气体放出且澄清石灰水未见浑浊,则假设二或三成立[或假设三不成立] (1分)
②
用胶头滴管向上述步骤后的B试管中滴入几滴品红溶液,震荡(1分)[或另取少量样品于试管中,滴入几滴蒸馏水震荡,再滴入品红溶液]
若品红不褪色,则假设二成立(1分);若品红褪色,假设三成立(1分)
本题解析:
(1)①实验室制取氯气的反应:MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
(2)漂白粉主要成分CaCl2、Ca(ClO)2,Ca(ClO)2变质会生成CaCO3。提出假设二:该漂白粉全部变质,含CaCO3、CaCl2。根据假设可知检测CaCO3的实验方案。
本题难度:一般