时间:2021-06-11 07:12:48
1、选择题 在下列各物质中,属于分子晶体且分子间存在范德华力和氢键,分子内只含极性共价键的是?(?)
A.CO2
B.H2O
C.HC1
D.NH4Cl
参考答案:
B
本题解析:
A中CO2分子内含O═C═O为极性共价键,但不存在氢键;B中H2O分子内H─O为极性共价键,分子间有氢键; HCl是分子晶体,分子间有范德华力,分子内为极性共价键;NH4Cl是由NH4+和Cl- 构成的离子晶体。
本题难度:简单
2、选择题 下列反应属于氧化还原反应的是
A.CaCO3=CaO+CO2↑
B.SO2+H2O=H2SO3
C.Na2CO3+2HCl=2NaCl+CO2↑+H2O
D.CH4+2O2=CO2+2H2O
参考答案:D
本题解析:分析:氧化还原反应的特征是化合价的升价,可根据元素的化合价是否发生变化判断反应是否属于氧化还原反应.
解答:A.反应前后元素的化合价没有发生变化,不是氧化还原反应,故A不选;
B.为化合反应,元素的化合价没有变化,不是氧化还原反应,故B不选;
C.为复分解反应,不是氧化还原反应,故C不选;
D.C和O元素的化合价发生变化,属于氧化还原反应,故D选.
故选D.
点评:本题考查氧化还原反应,题目难度不大,本题注意判断氧化还原反应的角度.
本题难度:简单
3、选择题 下列有关能量的叙述不正确的是
A.活化能的大小对化学反应前后的能量变化不产生影响
B.化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因
C.盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol
D.CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H= +2×283.0kJ/mol
参考答案:C
本题解析:中和热为稀的强酸和强碱溶液反应,生成1mol水时的反应热。可以表示为H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,C项还生成微溶的CaSO4,错误。
考点:化学反应中的能量变化。
本题难度:一般
4、填空题 (4分)(1)1g 硫粉在O2中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式
。
(2)若2.6 g 乙炔(C2H2,气态)完全燃烧生成液态水和CO2(g)时放热130 kJ。则乙炔燃烧的热化学方程式为 。
参考答案:(1)S(s) +O2(g)=SO2(g);DH =-299.52 kJ·mol-1;
(2)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);DH =-2600kJ·mol-1
本题解析:(1)1g 硫粉的物质的量为1/32moL,放出 9.36kJ热量,则1mol硫粉充分燃烧放出 299.52kJ热量,根据热化学方程式的书写原则可写出:S(s) +O2(g)=SO2(g);DH =-299.52 kJ·mol-1;
(2)2.6 g 乙炔完全燃烧生成液态水和CO2(g)时放热130 kJ则1moL乙炔完全燃烧生成水和二氧化碳放热1300KJ,则热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);DH =-2600kJ·mol-1
考点:考查热化学方程式的书写。
本题难度:一般
5、填空题 氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知: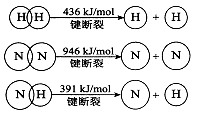
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。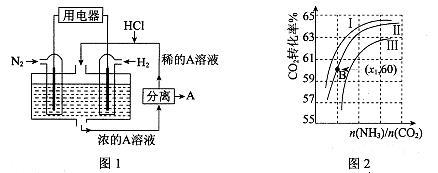
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比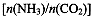 、水碳比
、水碳比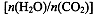 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
参考答案:(13分)
(1)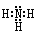 (2分)
(2分)
(2)①N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol
②增大
(3)N2+8H++6e-=2NH4+ (2分) NH4Cl (2分)
(4)Ⅲ (1分); 3 (2分)
本题解析:(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是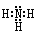
(2)①根据反应的△H=反应物的总键能-生成物的总键能,计算合成氨的△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl;
(4)氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,是Ⅲ曲线;B点二氧化碳的转化率是60%,氨气的转化率是40%,设NH3、CO2的起始物质的量分别为n1、n2,则n1×40%/2= n2×60%,解得n1/n2= x1=3。
考点:考查电子式、热化学方程式、电极反应式的书写,平衡移动的判断,化学平衡常数的判断,对图像的分析能力
本题难度:困难