时间:2021-06-11 07:12:48
1、选择题 下列哪一组元素的原子间反应可以形成离子键
| 原?子 | a | b | c | d | e | f | g |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
2、选择题 已知H2O2的分子空间结构可在二面角中表示,如图,则关于H2O2的说法正确的是(?)
A.H2O2分子的电子式为:H+[ ]2-H+
]2-H+
B.H2O2分子中共含14个电子
C.H2O2是非极性分子
D.H2O2分子正、负电荷重心不重合
3、选择题 下列说法正确的是(?)
A.难失去电子的原子,易形成阴离子
B.单质分子中不存在化学键,化合物的分子才存在化学键 ()
C.离子化合物中一定含有离子键
D.离子化合物中一定含金属键
4、实验题
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。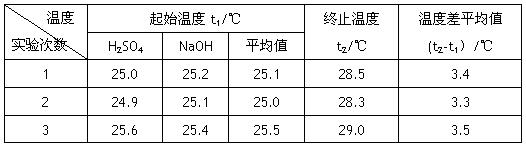
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c="4.18" J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
5、选择题 下列关于反应能量变化的相关常识论断错误的是
A.吸热反应不一定都要加热才反应
B.化学键的断裂和形成是化学反应中能量变化的根源
C.选择燃料只需考虑燃料热值大小
D.若反应物的总键能大于生成物的总键能则反应为吸热反应