时间:2021-06-11 07:07:58
1、实验题 某研究性学习?小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设?
①该反应的气体产物是CO2。 ②该反应的气体产物是CO。 ③该反应的气体产物是_____________。
设计方案?
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。 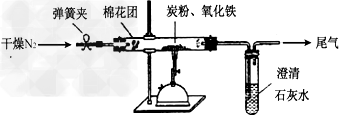
(2)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式____________________。
②该实验装置与实验室制取下列气体相同的是________(填标号);
A、用稀盐酸和锌反应制H2?
B、用MnO2和浓盐酸加热反应制Cl2?
C、用KClO3与MnO2共热反应制O2
(3)实验步骤
①?按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为________。
(4)数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式
________________________。
(5)实验优化?
学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是________________。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善:________。
参考答案:(1)CO2、CO的混合物
(2)NH4++NO2-==?N2↑+2H2O;B
(3)步骤②中是为了排尽空气;步骤④是为了赶出所有的CO2,确保完全吸收
(4)2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
(5)①Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全;M(BaCO3)>M(CaCO3),称量时相对误差小;②在尾气出口处加一点燃的酒精灯或增加一尾气处理装置
本题解析:
本题难度:一般
2、实验题 (12分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操 作几次。
作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)。
?。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管 。请填写下列空白:
。请填写下列空白: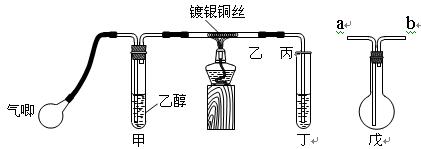
(1)甲装置常常浸在70~80℃的水浴中,目的是?。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为?。
②控制鼓气速度的方法是?,若鼓气速度过快则会?,若鼓气速度过慢则会?。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接?、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁 浸在 _____?中。
浸在 _____?中。
参考答案:
Ⅰ.操作麻烦、乙醇转化率低(其它合理答案均可)(2分)
Ⅱ.(1)使生成乙醇蒸气的速率加快(1分)
(2)①放热?(1分)? 2CH3CH2OH+O2 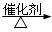 2CH3CHO+2H2O?(2分)
2CH3CHO+2H2O?(2分)
②控制甲中单位时间内的气泡数?
带走过多热量,难以保证反应所需温度?
反应放热太少,不能达到反应所需温度?(3分)
(3) b? a?(2分)?冰水?(1分)
本题解析:略
本题难度:简单
3、实验题 (18分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:? Fe3+、Br2哪一个的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液? b.CCl4?c.无水酒精? d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| ? | 选用试剂 | 实验现象 |
| 方案1 | ? | ? |
| 方案2 | ? | ? |
参考答案:(17分,方程式3分,其余每空2分)
(2) ①Br2 ②Fe3+
(3) 方案1:d 溶液呈红色 ?方案2:b CCl4层呈无色
(4) ①2Fe2++Br2===2Fe3++2Br- ?②1.2 mol/L
本题解析:略
本题难度:一般
4、选择题 根据下列实验现象,所得结论正确的是( )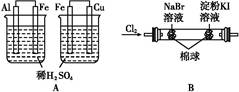
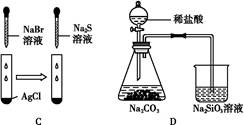
| 实验 | 实验现象 | 结论 |
| A | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 金属活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
参考答案:A
本题解析:活泼的金属作负极,失电子,较不活泼的金属作正极,H+在正极得电子析出氢气,所以金属活动性:Al>Fe>Cu,A正确;B中只能得出氧化性:Cl2>Br2;Cl2>I2,不能比较Br2与I2的氧化性,B错误;C中发生了沉淀的转化,溶解性大的难溶物转化为溶解性小的难溶物,所以得到结论为:溶解性:AgCl>AgBr>Ag2S,C错;利用酸性强弱比较非金属的非金属性强弱时只能是其最高价含氧酸,这里用盐酸,不能得出相应的结论,D错。
本题难度:简单
5、选择题 下列实验设计成功的是
| ? | 实验目的 | 实验步骤及现象 |
| A | 检验Fe(NO3)2试样是否变质 | 试样加水溶解,加盐酸酸化,加KSCN溶液,出现血红色 |
| B | 检验某卤代烃是否是氯代烃 | 试样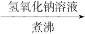 冷却 冷却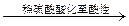 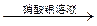 出现白色沉淀 出现白色沉淀 |
| C | 证明酸性条件H2O2氧化性比I2强 | NaI溶液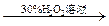 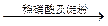 溶液变蓝色 溶液变蓝色 |
| D | 除去氯化钠晶体中少量硝酸钾 | 试样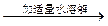 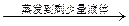   重结晶 重结晶参考答案:D 本题解析:A项,加盐酸酸化,Fe2+被HNO3氧化为Fe3+,无法确定是否变质。B项,不能用H2SO4酸化,因为Ag2SO4也是白色沉淀,应用HNO3酸化。C项,HNO3也能氧化I-,不能确定是否为H2O2氧化的I-。 本题难度:简单 |