时间:2021-06-11 07:02:45
1、选择题 下列物质的电离方程式,错误的是( )
A.HCl=H++Cl-
B.H2SO4=2H++SO42-
C.FeCl3=Fe3++Cl-
D.Ca(OH)2=Ca2++2OH-
2、选择题 下列溶液中一定呈中性的是
A.pH=7的溶液
B.由强酸、强碱等物质的量反应得到的溶液
C.c(H+)=c(OH—)的溶液
D.非电解质溶于水得到的溶液
3、选择题 已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题: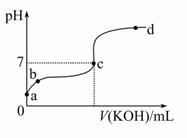
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度大小顺序为 或 或 。c点溶液中的离子浓度大小顺序为 。
(3)a、b、c三点中水的电离程度最大的是 ,滴定过程中宜选用 作指示剂。
4、填空题 (12分)已知: H2O  H+ + OH-(△H>0),KW为水的电离常数,完成下表。
H+ + OH-(△H>0),KW为水的电离常数,完成下表。
| 改变条件 | 电离平衡移动方向 | 溶液中c(H+) | PH的变化 | KW | |
| 升高温度 | | | | | |
| 加入酸 | | | | | |
| 加入Na | | | | | |
5、选择题 pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则溶液中c(H+)为(mol/L):
A.(4×10-9 + 1×10-12) 1/5
B.(8×10-9 + 1×10-12) 1/5
C.5×10-10
D.5×10-12