时间:2021-06-11 07:00:12
1、选择题 下列有关除杂的叙述正确的是
A.除去苯中的苯酚:加入浓溴水后,过滤
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液
C.除去CO2中少量的HCl:气体通过盛有NaOH溶液的洗气瓶
D.除去FeCl3溶液中少量的CuCl2:用足量铁粉,过滤
参考答案:B
本题解析:苯酚与浓溴水反应生成的三溴苯酚可溶于苯不可采用过滤的方法,A错;乙酸乙酯不
溶于饱和碳酸钠,而乙酸与碳酸钠反应,B正确;NaOH不仅除去HCl也除去了CO2,C错;
铁粉与FeCl3及CuCl2均可反应,D错。
本题难度:困难
2、选择题 114号元素的一种同位素是由俄罗斯科学家合成的,存在时间只有30s,其质量数为289,该原子的中子数与电子数之差为
A.61
B.114
C.175
D.289
参考答案:A
本题解析:根据质量数=质子数+中子数,可得中子数为289-114=175,质子数=电子数=114,可得中子数与电子数只差为175-114=61,选A。
本题难度:一般
3、选择题 已知aAn+、bB(n+1)+、cCn-、D(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是(? )
A.原子半径:A>B>C>D
B.原子序数:b>a>c>d
C.离子半径:D>C>B>A
D.金属性:B>A;非金属性:D>C
参考答案:B
本题解析:由已知,A、B为金属,C、D为非金属,由于离子的电子层结构相同,原子序数的关系为:b>a>c>d;离子半径:D>C>A>B;金属性:A>B,非金属性C>D。
本题难度:简单
4、填空题 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为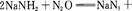
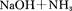
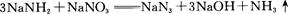 回答下列问题:
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是?,第一电离能最小的元素是?。
(2)基态氮原子的L层电子排布图为?。
(3)与N3-互为等电子体的分子为?(写出一种)。依据价层电子对互斥理论,NO3-的空间构型为?。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为?。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:?。
(5)N20沸点(一88.49℃比NH3沸点(一33.34℃)低,其主要原因是?
(6)安全气囊的设计原理为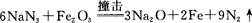
①氮分子中δ键和π键数目之比为?。
②铁晶体中存在的化学键类型为?。
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为
?(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。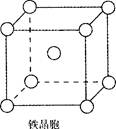
参考答案:22. (1)氟(或F)?锂(或Li)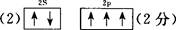
(3)CO2或N2O?平面三角形
(4)离子晶体(1分)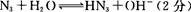
(5)氨分子间存在氢键?(6)1:2?金属键?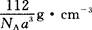
本题解析:(1)氮元素在第二周期,同周期,从左向右电负性依次增大(稀有气体除外),故为氟;第一电离能逐渐增大,故最小的为锂;(2)氮原子L层上有5个电子,先排s上的2个电子,再排p上的三个电子;(3)N3-价电子总数为16,等电子体的为价电子总数相等的CO2或N2O;先算出孤电子对数为(5+1-2×3)/2=0,成键电子对为3,故为sp2杂化,故为平面三角形;(4)两者均含有钠离子和阴离子,故为离子晶体,盐溶液显碱性为阴离子水解,故为N3-结合水电离出的氢离子生成氨气和氢氧根离子;(5)氨气分子能形成分子间氢键,沸点升高;(6)①氮气中形成氮氮三键,有一条δ键和2条π键,故为1:2;②铁为金属晶体,存在金属键;③晶胞的体积为a3,有8个铁原子位于顶点,一个位于中心,故晶胞完全占有的铁原子数目为2个,质量为 ×2g,质量除以体积得密度。
×2g,质量除以体积得密度。
本题难度:一般
5、选择题 下列说法中,错误的是
A.元素周期表中有7个主族、7个副族
B.碳元素位于第二周期IVA族
C.稀有气体元素原子的最外层电子数均为8个
D.氢分子中的化学键是共价键
参考答案:C
本题解析:元素周期表中有7个主族、7个副族和一个Ⅷ族,A正确;He是稀有气体元素,但其最外层电子数为2个,C错误;氢分子以共用电子对存在,是共价键,D正确。故答案选C。
点评:元素周期表是高考必考知识点,考生在备考中应掌握周期表的编排原则,并注意积累掌握短周期元素的结构与性质。
本题难度:一般