时间:2021-06-11 07:00:12
1、选择题 2011年3月,日本发生特大地震,造成福岛核电站放射性核素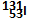 的泄漏。下列有关
的泄漏。下列有关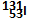 的叙述错误的是
的叙述错误的是
A.电子数为78
B.质子数为53
C.中子数为78
D.质量数为131
参考答案:A
本题解析:根据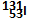 可以确定质子数为53,质量数为131,电子数为53,中子数为131-53=78,所以答案选A。
可以确定质子数为53,质量数为131,电子数为53,中子数为131-53=78,所以答案选A。
本题难度:简单
2、选择题 下列分子中所有原子都满足最外层为8电子结构的是
A.CCl4
B.H2O
C.BF3
D.PCl5
参考答案:A
本题解析:主要分子中元素化合价的绝对值与该元素原子的最外层电子数之和满足8,即可以满足该原子是8电子稳定结构,据此可知选项A正确。B中H元素,C中B元素,D中P元素均不能满足8电子的稳定结构,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力,该题的关键是明确判断8电子稳定结构的依据,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 下列分子或离子不能跟质子结合的是( )
A.NH3? B.H2O? C.OH-? D.NH4+
参考答案:D
本题解析:氨气能和质子结合生成NH4+,水能和质子结合生成H3O+,OH-能和质子结合生成水,所以不能和质子结合的是NH4+,答案选D。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是记住常见能和氢离子反应的有关微粒,有助于提高学生的答题效率。
本题难度:简单
4、选择题 下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素X、Y能形成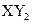 型化合物,则X与Y 的原子序数之差可能为2或5
型化合物,则X与Y 的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
参考答案:B
本题解析:略
本题难度:简单
5、选择题 (6分)(2012?广东)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )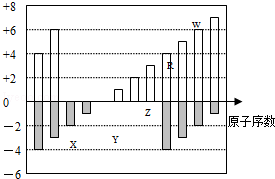
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
参考答案:BD
本题解析:为短周期元素,有两种元素既有+4价,又有﹣4价,故前一种元素为碳,后一种元素为硅,故R为Si元素,X的化合价为﹣2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、﹣2价,故W为S元素.
解:为短周期元素,有两种元素既有+4价,又有﹣4价,故前一种元素为碳,后一种元素为硅,故R为Si元素,X的化合价为﹣2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、﹣2价,故W为S元素,
A、同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>O,即Y>Z>X,故A错误;
B、虽然非金属性S>Si,但SiH4的分解温度比H2S高,较稳定,故B正确;
C、SO3与H2O化合生成H2SO4,H2SO4是共价化合物,故C错误;
D、NaOH与Al(OH)3能发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,故D正确;
故选BD.
点评:本题考查结构性质与位置关系、元素周期律等,难度不大,根据推断元素是解题的关键,根据化合价结合原子序数进行推断,首先审题中要抓住“短周期元素”几个字.
本题难度:一般