时间:2021-06-11 06:59:29
1、选择题 已知在1×105?Pa,298?K条件下,4g?氢气燃烧生成液态水放出572?kJ热量,下列表示氢气燃烧的热化学方程式的是
[? ]
A.H2O(g)?=?H2(g)+1/2O2(g)?△H=+286kJ/mol
B.2H2(g)+?O2(g)=2H2O(l)?△H=-572kJ/mol
C.H2(g)+?1/2O2(g)=?H2O(g)?△H=-286kJ/mol
D.H2(g)+1/2O2(g)=H2O(l)?△H=+286?kJ/mol
参考答案:B
本题解析:
本题难度:简单
2、填空题 (8分)已知下列热化学方程式:
①H2(g)+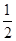 O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+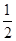 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+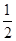 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列各问题:
(1)上述反应中属于放热反应的是_______________________________________。
(2)H2的燃烧热为________;C的燃烧热为________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热为________;其热化学方程式为______________。
参考答案:(8分)(1)①②③④(2分)
(2)-285.8 kJ·mol-1(1分);-393.5 kJ·mol-1(1分)
(3)1 429.0 kJ (1分)
(4)-283.0 kJ·mol-1 (1分)
CO(g)+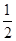 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 (2分)
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 (2分)
本题解析:(1)焓变小于零,反应放热,答案为①②③④;(2)燃烧热是指常温下1mol物质完全燃烧生成稳定的氧化物所放出的热量,所以H2的燃烧热为①-285.8 kJ·mol-1;C的燃烧热为④-393.5 kJ·mol-1;(3)燃烧10 g H2生成液态水,放出的热量用①式计算为285.8 kJ·mol-1×10g/2g/mol=1429kJ;(4)根据盖斯定律由④式减去③式得CO(g)+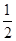 O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 。
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 。
考点:反应热及其计算
本题难度:一般
3、填空题 (8分)氨气主要用作致冷剂及制取铵盐和氨肥
(1)某研究小组在673K、30MPa条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.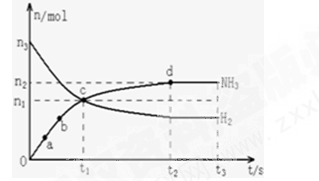
下列叙述正确的是 .
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673K升至773K,则n(H2)将增大
D.t2、t3时刻,n(N2)不相等
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.①3min内以H2表示的化学反应速率 ;②该条件下的平衡常数
(3)已知:N2(g)+O2(g)=2NO(g)△H= +180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H= -483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
参考答案:(1)AC ;(2)①0.2mol·L-1·s-1; ②0.4(mol/L)-2;
(3)4NH3(g)+5O2(g)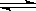 4NO(g)+6H2O(g) △H=-905kJ/mol;
4NO(g)+6H2O(g) △H=-905kJ/mol;
本题解析:(1)A、氨气的物质的量越小,反应物的物质的量越大,反应物浓度越大正反应速率越快;B、c点以后氨气、氢气的物质的量发生变化;C、升高温度平衡向吸热方向移动;D、t2、t3时刻,可逆反应处于平衡状态。
(2)对于可逆反应: N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始物质的量浓度(mol/L) 0.6 1.6 0
转化物质的量浓度(mol/L) 0.2 0.6 0.4
平衡物质的量浓度(mol/L) 0.4 1 0.4
①3min内以H2表示的化学反应速率v(H2)=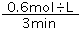 =0.2mol/(L?min)。
=0.2mol/(L?min)。
答:3min内以H2表示的化学反应速率为0.2mol/(L?min)
②平衡常数k=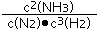 =
=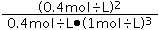 =0.4L2/mol2.
=0.4L2/mol2.
答:该条件下的平衡常数为0.4L2/mol2。
(3)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)
本题难度:一般
4、选择题 下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
参考答案:C
本题解析:
本题难度:简单
5、填空题 A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 原子的第一电离能在第三周期中最小 |
| D | 基态原子最外层电子排布为(n+1)sn (n+1)p(n+2) |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
参考答案:
(1)三 ⅠA 1s22s22p63s23p63d64s2(或[Ar]3d64s2);
(2)S2-> O2-> Na+ H2O
(3)离子键、共价键 离子
(4)3Fe3O4+8Al 4Al2O3+9Fe
4Al2O3+9Fe
(5)2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH= -270.0kJ/mol
本题解析:
A、原子核外L层电子数是K层的2倍,K层是2个电子,则L层是4个,则A为C元素;
B、地球生物的保护伞是臭氧层,则B为O元素;
C、在第三周期中第一点能最小的为第一主族的碱金属,则C为Na元素;
D、(n+1)s2(n+1)p(n+2)由s层是2个电子可知,n=2,则D为S;
E、具有磁性的黑色晶体是Fe3O4,则E为Fe;
(1)C为Na元素,在周期表中的位置为第三周期第ⅠA族,E为Fe,核外电子排布式为:1s22s22p63s23p63d64s2
(2)B、C、D的简单离子化合物分别为:O2-、Na+、S2-,电子层数越多,半径越大,相同电子层数情况下,核电荷数越多,半径越小,则S2-> O2-> Na+;B、D的简单气态氢化物分别为:H2O、NH3,非金属性越强,气态氢化物越稳定,O的非金属性比N强,则H2O的稳定性强于NH3。
(3)O2和Na按物质的量比为1:2反应,则产物为Na2O2,其中Na+和O22-之间形成离子键,O22-中氧原子之间形成共价键;物质结构中只要含有离子键,该化合物就为离子晶体。
(4)铝热反应为单质铝置换金属氧化物中金属的反应,E的黑色磁性晶体为Fe3O4
(5)利用盖斯定律,1式减去2式,得到所需的热化学反应方程式
考点:本题以物质结构为基础,考查了元素周期表、元素周期律,分子结构、晶体结构,元素及化合物的性质,热化学方程式及反应热的计算、盖斯定律等。
本题难度:困难