时间:2021-06-11 06:59:29
1、填空题 1molC、1molCO分别按下式反应,回答下列问题:C(S)+1/2O2(g)=CO(g)?放出110.5KJ热量?CO(g)+1/2O2(g)=CO2(g)?放出283.0KJ热量? C(S)+O2(g)=CO2(g)?放出393.5KJ热量
(1)结合数据和反应产物说明,煤炭充分燃烧优点是:______,______.
(2)单质碳通过先与氧气反应生成CO(g),再与氧气反应生成CO2(g),所放出的热量之和______(填大于、等于或小于)相同质量的碳与氧气完全燃烧生成CO2(g)所放出的热量
(3)已知C(金刚石,S)+O2(g)=CO2(g)?放出热量为Q1 C(石墨,S)+O2(g)=CO2(g)?放出热量为Q2,且Q1>Q2则C(金刚石,S)=C(石墨,S)为______(填吸热或放热)反应,放出热量为______KJ(用Q1、Q2表示)
2、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ·mol-1
下列说法正确的是
[? ]
A.CH3OH的反应热不仅与各物质的状态有关,也与参加反应的反应物的量有关
B.CH3OH蒸气的燃烧热大于676.7kJ·mol-1
C.CH3OH转变成H2的过程只能是一个从高能量到低能量的过程
D.根据①推知反应:CO2(g)+3H2(g)=CH3OH(l)+H2O(g) 的△H<-49.0kJ·mol-1
3、填空题 氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图: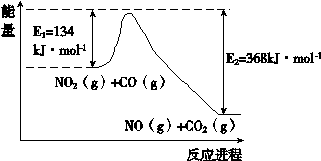
写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1 K2(填“>”、“=”或“<”)
| T /K | 298 | 398 |
| 平衡常数K | K1 | K2 |
4、简答题 已知热化学方程式:
Mg(OH)2(S)=MgO(S)+H2O(g);△H1=+81.5kJ/mol
Al(OH)3(S)=
| 1 2 |
| 2 3 |
5、填空题 光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为?890.3kJ?mol?1、?285. 8 kJ?mol?1和?283.0 kJ?mol?1,则1molCH4与CO2反应的热化学方程式是
(3)COCl2的分解反应为COCl2(g) Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g) △H=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min的COCl2浓度变化曲线未示出):
①比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”)
②比较反应物COCl2在5?6min和15?16 min时平均反应速率的大小:v(5?6)
v(15?16)(填“<”、“>”或“=”),原因是 。
③计算反应在第8 min时的平衡常数K= ;(列出计算过程,结果保留两位小数)