时间:2021-06-11 06:51:32
1、选择题 下列有关化学研究的正确说法是
[? ]
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
2、选择题 已知工业上真空炼铷的原理如下:2RbCl+Ca CaCl2+2Rb↑,对于此反应的进行能给予正确解释的是(?)
CaCl2+2Rb↑,对于此反应的进行能给予正确解释的是(?)
A.铷的金属活动性不如钙强,故钙可置换铷
B.铷的沸点比钙低,把铷蒸气抽出时,平衡右移
C.该反应与金属活动顺序矛盾,该反应不能进行
D.铷的单质比铷的化合物更稳定
3、选择题 下图曲线a表示放热反应X(g)+Y(g)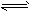 Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
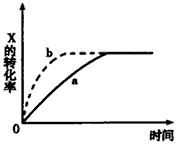
[? ]
4、选择题 在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为
B(g)+C(g)。当物质A的起始浓度为
1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示
则下列有关说法中正确的是
[? ]
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件IV和条件II相比较,条件IV时可能缩小了容器体积
5、选择题 (2分)下图表示在密闭容器中反应:CO2(g)+C(s) 2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是?;bc过程中改变的条件可能是?;
2CO(g)△H>0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是?;bc过程中改变的条件可能是?;