时间:2021-06-11 06:38:23
1、填空题 (9分)某厂的酸性工业废水中含有一定量的。Fe3+、Cu2+等离子。有入设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中生产一定量的铁红和氧化铜。
填写下面空白:
(1)图中标号②处需加入的相应物质是
(2)若需证明D溶液中是否含有Fe3+,需要选择的试剂是?(填化学式)。
(3)写出①处发生反应的离子方程式?。
写出③处发生反应的化学方程式?。
(4)铁红的化学式为?,写出铁红在工业上的一种主要用途?。
2、选择题 下列各组反应,最终一定能得到白色沉淀的是( )
A.向Na2SiO3溶液中加入稀盐酸
B.向CuSO4溶液中加入NaOH溶液
C.向FeCl2溶液中加入过量NaOH溶液
D.向Al2(SO4)3溶液中加入过量NaOH溶液
3、选择题 下列离子方程式正确的是
A.碳酸氢钠水解:HCO3-+H2O?H3O++CO32-
B.醋酸铵溶于水:CH3COONH4+H2O?CH3COOH+NH3?H2O
C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s)+CO32-?(aq)?CaCO3(s)+SO42-?(aq)
D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O
4、填空题 实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无
色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如下表。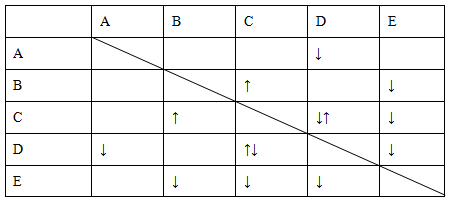
表中“↑”表示生成气体物质,“↓”表示生成沉淀。
根据以上信息,回答以下问题。
(1)B、E的化学式分别为________、________。
(2)写出A的电离方程式:________。
(3)C、D两溶液反应的离子方程式为________。
(4)向含有0.1 mol溶液的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为________mol。
5、选择题 某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,且这四种离子Fe3+、SO42-、Al3+和M的物质的量之比为2∶4∶1∶1,则M离子可能为下列中的
A.Na+
B.I-
C.S2-
D.Cl-