时间:2021-06-11 06:38:23
1、选择题 下列反应中是离子反应,又是氧化还原反应的是:?
A.Fe + CuS O4 =" Cu" + FeSO4
O4 =" Cu" + FeSO4
B.2Na + Cl2 2 NaCl
2 NaCl
C.NaCl + AgNO3 =" AgCl↓+" NaNO3
D.2KClO3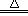 2KCl + 3O2↑
2KCl + 3O2↑
2、填空题 氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是________mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_________________________________________________________________。
3、选择题 下列各组离子能在指定溶液中大量共存的是
①无色溶液中:Al3+,Cl-,Na+,HCO3-,SO42-
②使pH=11的溶液中:Na+,AlO2-,NO3-,S2-,SO32-
③加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,K+,SO42-
④使pH试纸呈红色的溶液中:Fe3+,MnO4-,Na+,SO42-
⑤酸性溶液中:Fe2+,Al3+,NO3-,I-.
A.①②④
B.①⑤
C.②③④
D.①②③
4、填空题 以下表格中的实验是以CuSO4为例,分析电解质在溶液里所起反应的实质 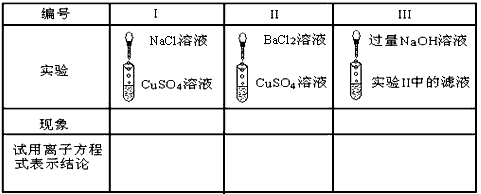
5、选择题 下列离子方程式正确的是
A.把CO2通入CaCl2溶液:Ca2++CO2+H2O==CaCO3↓+2H+
B.Al和NaOH溶液反应:Al+2OH-=AlO-2+H2↑
C.把SO2通入酸性KmnO4溶液中:5SO2+2MnO-4+2H2O=5SO2-4+2Mn2++4H+
D.NaAlO2溶液中通入过量CO2气体:2AlO-2+CO2+3H2O=2Al(OH)3↓+CO2-3