时间:2021-06-11 06:35:02
1、选择题 图中a、b、c、d、e、f表示元素周期表中部分短周期元素,下列叙述正确的是( )
A.a、b、c的简单离子中,c的离子半径最大
B.c、d、f最高价氧化物对应的水化物两两之间均可发生反应
C.e的氢化物比f的氢化物的稳定性高
D.a、e可形成一种新型无机非金属材料--高温结构陶瓷
参考答案:a、b、c、d、e、f是短周期元素,由各元素在元素周期表中位置可知,a为氮元素、b为氧元素、c钠元素、d为铝元素、e为硅元素、f为氯元素.
A、a为氮元素、b为氧元素、c钠元素,原子形成的离子电子层结构相同,电子层结构相同,核电荷数越大离子半径越小,所以a、b、c的简单离子中,c的离子半径最小,故A错误;
B、c钠元素、d为铝元素、f为氯元素,最高价氧化物对应的水化物为氢氧化钠、氢氧化铝、高氯酸,氢氧化铝是两性氢氧化物,溶于氢氧化钠、高氯酸溶液,氢氧化钠与高氯酸发生中和反应,故B正确;
C、e为硅元素、f为氯元素,非金属性Si<Cl,非金属性越强,氢化物越稳定,所以f的氢化物的稳定性高,故C错误;
D、a为氮元素、e为硅元素,氮化硅是一种新型无机非金属材料--高温结构陶瓷,故D正确.
故选BD.
本题解析:
本题难度:一般
2、选择题 下图为短周期的一部分,推断关于Y、Z、M的说法正确的是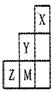
[? ]
A.非金属性:Y>Z>M
B.原子半径:M>Z>Y
C.气态氢化物的稳定性:Y<M<Z
D.ZM2分子中各原子的最外层电子均满足8e-稳定结构
参考答案:D
本题解析:
本题难度:一般
3、选择题 A、B是元素周期表中相邻两主族的两种元素,若A的原子序数为a,以下不可能是B的原子序数的是
A.a-17
B.a-7
C.a+18
D.a+19
参考答案:C
本题解析:由4个选项可知A和B不是同周期的元素.由于各周期内元素数目都是偶数,所以同主族内元素原子序数之差是偶数,相邻主族元素原子序数之差是奇数.
本题难度:困难
4、选择题 下列分子中各原子最外层都满足8电子稳定结构的是
A.CH4
B.PCl5
C.CCl4
D.SF6
参考答案:C
本题解析:CH4中氢原子核外有两个电子;PCl5、SF6的P与S原子最外层超8电子;
本题难度:困难
5、推断题 已知A、B、C、D、E是短周期中的5中非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易容于二硫化碳。
(1)请写出元素符号:A______,B______,C_______,D_______,E_________?
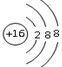
(2)画出E的阴离子的结构示意图:___________
(3)A的单质和C的单质在一定条件下反应生成化合物X,该反应的化学方程式为_____________。向X的水溶液中滴入酚酞溶液,会观察到____________。?
参考答案:(1)A:?H;B:?C;C:?N;D:?O;E:?S
(2)
(3)N2+3H2 2NH3;溶液颜色变红
2NH3;溶液颜色变红
本题解析:
本题难度:一般