时间:2021-06-11 06:32:33
1、选择题 下列说法正确的是(?)
A.能电离出H+的化合物叫做酸
B.实验测得1mol某气体体积为22.4L,测定条件一定是标准状况
C.摩尔是用来描述微观粒子的物理量。
D.化合物分为酸、碱、盐和氧化物是用树状分类法分类的
参考答案:D
本题解析:A项:酸是指溶液中电离时阳离子完全是氢离子的化合物。NaHSO4在水溶液中可以电离出H+,但NaHSO4属于盐而不是酸。
B项:气体的体积受温度、压强的影响很大,所以实验测得1mol某气体体积为22.4L,测定条件并不一定是标准状。
C项:物质的量是用来描述微观粒子的物理量,而摩尔是物质的量的单位。
故选D。
点评:注意课本上对酸、摩尔概念的理解。在标准状况下,实验测得1mol某气体体积为22.4L,标准状况是指0 ℃(273.15 K)、101kPa,因此气体体积受到温度、压强的影响很大。
本题难度:简单
2、选择题 FeCl3可用作印刷电路铜板腐蚀剂。为回收废腐蚀液中的铜,必须对废腐蚀液的组成进行分析。某同学取废腐蚀液200 mL,分成甲、乙两等份。向甲溶液中滴加AgNO3溶液至不再有沉淀产生,得到沉淀129.15 g;向乙溶液中加入10 g足量铁粉,充分反应,剩余固体质量4.8 g。计算中忽略溶液体积的变化。
(1)废腐蚀液中Cl-的物质的量浓度是________。
(2)废腐蚀液中Cu2+的物质的量浓度是________。
参考答案:(1)9 mol/L (2)0.5 mol/L
本题解析:(1)n(Cl-)=n(AgCl)=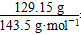 =0.9 mol,c(Cl-)=0.9/0.1=9 mol/L。
=0.9 mol,c(Cl-)=0.9/0.1=9 mol/L。
(2)在FeCl3与Cu反应后的废液中含有FeCl3、FeCl2和CuCl2,向其中加入过量Fe,最终溶液中的溶质是FeCl2,从整个反应过程看,相当于FeCl3与Fe反应生成FeCl2。n(Cu)×64 g/mol+10 g-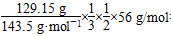 =4.8 g,则n(Cu)=0.05 mol,n(Cu2+)=n(Cu)=0.05 mol。c(Cu2+)=0.05 mol÷0.1 L=0.5 mol/L。
=4.8 g,则n(Cu)=0.05 mol,n(Cu2+)=n(Cu)=0.05 mol。c(Cu2+)=0.05 mol÷0.1 L=0.5 mol/L。
本题难度:一般
3、选择题 以NA表示阿伏伽德罗常数,下列说法中正确的是
①58.5 g氯化钠固体中含有NA个氯化钠分子;
②5.6 g铁粉与酸反应失去的电子数一定为0.2 NA;
③6.0 g金刚石中含有的共价键数为NA;
④标况下,11.2 L SO3所含的分子数为0.5 NA;
⑤1L 1 mol·L-1 AlCl3溶液中含有NA个胶粒Al3+;
⑥常温下,42 g C2H4和C4H8的混合物中含有的碳原子数为3 NA
A.⑤⑥
B.④⑤⑥
C.③⑥
D.①②③
参考答案:C
本题解析:①氯化钠是离子化合物,没有氯化钠分子。错误。②在和盐酸反应时铁原子失去2个电子。正确。③金刚石中每个C原子与相邻的四个C原子形成四个共价键。6.0 g金刚石中含有的共价键数为{(6/12)×2}×NA=NA。正确。④SO3的熔点是16.8度,在标况下,SO3是固体。不能用气体摩尔体积。错误。⑤在溶液中盐水解的程度时微弱的,错误。⑥烯烃的分子式通式是CnH2n.最简式是CH2。42 g C2H4和C4H8的混合物中含有最简式的物质的量为3mol.所以含有的碳原子数为3 NA正确。正确的说法是③⑥。选项为:C.
本题难度:一般
4、填空题 实验室要用98%(密度为1.84g?cm-3)的硫酸配制3.68mol/L的硫酸500mL.实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸?③溶解
④转移、洗涤?⑤定容、摇匀
回答下列问题
(1)需准确量取98%的硫酸______mL.量取浓硫酸所用的量筒的规格是______
(从下列中选用?A.10ml?B.20ml?C.50ml?D.100ml)
(2)要配制3.68mol/L的硫酸500mL,必须用到的仪器是(填写序号)______.
①500mL量筒 ②烧杯 ③1?000mL容量瓶 ④500mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是______(选填序号).
A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切
E.所用的浓硫酸长时间放置在密封不好的容器中
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?______.
参考答案:(1)浓硫酸的浓度=C=103ρwM=103×1.84×98%98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=3.68mol/L×0.5L,V=0.1L=100mL,量取浓硫酸所用的量筒的规格是100mL,故答案为:100;D;?
(2)需要的仪器有:用于稀释浓硫酸的烧杯、配制溶液的500mL容量瓶、定容用的胶头滴管、引流和搅拌使用的玻璃棒,故选②④⑥⑧;
(3)A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒,溶质的物质的量偏小,配制溶液的浓度偏低;
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外,溶质的物质的量偏小,配制溶液的浓度偏低;
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切,溶质的物质的量偏小,配制溶液的浓度偏低;
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切,溶液体积偏大,配制溶液浓度偏低;
E.所用的浓硫酸长时间放置在密封不好的容器中,溶质的物质的量偏小,配制溶液浓度偏低;
故选ABCDE;
(4)若配制时,因加水不慎超过了容量瓶刻度线,需要重新配置,故答案为:重新配置.
本题解析:
本题难度:一般
5、实验题 (10分)甲、乙两人分别用不同的方法配制100 mL 3.6 mol/L的稀硫酸.
(1)甲:量取20 mL 18 mol/L浓硫酸,小心地倒入盛有少量水的烧瓶中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加入水至刻线定容,塞好瓶塞,反复上下颠倒摇匀.
①实验所用的玻璃仪器除烧杯和容量瓶外,还有__________________________?。
②将溶液转移到容量瓶中的正确操作是________________________________。
③定容的正确操作是_________________________________________。
(2)乙:用100 mL量筒量取20 mL 18 mol/L浓硫酸,并向其中小心地加入少量水,搅拌均匀,等冷却至室温后,再加入水至100 mL刻线,再搅拌均匀.你认为此法是否正确?若不正确,指出其中错误之处_________?。
参考答案:(10分)(1)①量筒、玻璃棒、胶头滴管(3分) ②将玻璃棒插入容量瓶刻度线以下,将溶液沿玻璃棒慢慢地倒入容量瓶中(2分) ③加水至刻度线1~2 cm处时,改用胶头滴管滴加水至液面与刻度线相切(3分)
(2)不能用量筒配制溶液,不能将水加入到浓硫酸中(2分)
本题解析:考查一定物质的量浓度溶液的配制。
(1)①液体量取需要量筒,稀释和转移液体还需要玻璃棒,定容时还需要胶头滴管。
②转移液体时需要玻璃棒引流,所以正确的操作是将玻璃棒插入容量瓶刻度线以下,将溶液沿玻璃棒慢慢地倒入容量瓶中。
③定容时需要胶头滴管,因此正确的操作是加水至刻度线1~2 cm处时,改用胶头滴管滴加水至液面与刻度线相切即可。
(2)根据操作过程可知,错误的操作是第一量筒不能用来稀释溶液或溶解固体;其次由于浓硫酸溶于水放出大量的热,所以稀释浓硫酸时,应该将浓硫酸注入水中。并不断的用玻璃棒搅拌,所以第二处错误是不能将水加入到浓硫酸中。
本题难度:一般