时间:2021-06-11 06:32:33
1、选择题 混合气体由N2和CH4组成,测得混合气体在标准状况 下的密度为0.821 g / L,则混合气体中N2和CH4的体积比为
下的密度为0.821 g / L,则混合气体中N2和CH4的体积比为
A.1:1
B.1:4
C.4:1
D.1:2
参考答案:B
本题解析:略
本题难度:一般
2、选择题 在50mL bmol·L-1的AlCl3溶液中加入50mL amol·L-1 NaOH溶液。
(1)当a、b满足_____________________条件时,无沉淀产生。
(2)当a、b满足_____________________条件时,先有沉淀生成,后又有部分沉淀溶解,此时Al(OH)3的质量为_____________________克。
参考答案:(1)a≥4b?(2)3b<a<4b; 3.9(4b-a)
本题解析:在AlCl3溶液中加入NaOH溶液时首先发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl 。产生白色沉淀;当NaOH过量时发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O 。沉淀又溶解。由方程式可看出n(OH-)<3n(Al3+)时,有白色沉淀,当n(OH-)=3n(Al3+)时,沉淀达到最大值。当4n(Al3+)>n(OH-)>3n(Al3+)时,沉淀逐渐溶解。当n(OH-)≥4n(Al3+)时,沉淀完全溶解。由于AlCl3溶液与NaOH溶液的体积相同,所以二者的浓度比就是二者的物质的量的比。(1)当a、b满足 a≥4b条件时,无沉淀产生。(2)当沉淀达到最大值时, n(Al(OH)3)=n(Al3+)=0.05mol.m(Al(OH)3)= 0.05mol×78g/mol=3.9g.当a、b满足3b<a<4b时,先有沉淀生成,后又有部分沉淀溶解,根据方程式Al(OH)3+ OH-= AlO2-+ 2H2O可知1mol的NaOH溶解1mol的Al(OH)3。所以此时Al(OH)3的质量为3.9(4b-a)g.3溶液与NaOH溶液反应产生的沉淀的质量关系的知识。
本题难度:一般
3、选择题 20?g?A物质和14?g?B物质恰好完全反应,生成8.8?g?C物质、3.6?g?D物质和0.2?mol?E物质,则E物质的摩尔质量为
[? ]
A.100?g/mol?
B.55?g/mol?
C.108?g/mol?
D.96?g/mol
参考答案:C
本题解析:
本题难度:一般
4、选择题 科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A.由已知信息可得: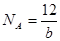
B.Wg该原子的物质的量一定是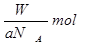
C.Wg该原子中含有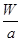 个该原子
个该原子
D.该原子的摩尔质量是aNA
参考答案:D
本题解析:摩尔质量的单位是g/mol,所以选项D不正确,其余都是正确的,答案选D。
本题难度:一般
5、填空题 27.2g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,ACl2的摩尔质量是 ,A的相对原子质量是 。
参考答案:136 g/mol 65
本题解析:27.2g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,则ACl2的物质的量为0.2 molACl2的摩尔质,M=m/n=27.2g÷0.2 mol="136" g/mol,该物质的相对分子质量为136,A的相对原子质量为136-35.5×2=65
考点:有关物质的量、相对原子质量的计算。
本题难度:一般