时间:2021-06-11 06:32:06
1、选择题 某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为1∶1∶6。下列有关该溶液的判断正确的是( )
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀氢氧化钠溶液,立即出现白色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为1
D.向该溶液中加入过量铁粉,只发生置换反应
参考答案:C
本题解析:氧化性较强的Fe3+能氧化还原性较强的I-,Fe3+的浓度会减小,A不正确;Fe3+和OH-生成红褐色沉淀,B不正确;根据电荷守恒可知,溶液中c(H+)与c(Cl-)之比为1∶6,若溶液中c(Cl-)=0.6 mol·L-1,则c(H+)=0.1 mol·L-1,溶液的pH为1,C正确;加入铁粉不仅会发生与H+的置换反应,还会发生与Fe3+的化合反应,D不正确。
本题难度:一般
2、选择题 下列离子化合物,熔点最高的是
A.氯化钠
B.氯化钾
C.氯化锂
D.氯化铯
参考答案:C
本题解析:离子化合物熔、沸点的高低取决于离子键的强弱,离子键越强,破坏它就越难,即所需提供的热能越多,其熔、沸点就越高.离子键的强弱,取决于离子半径的大小和离子所带电荷数的多少,离子半径之和越短,离子所带电荷越多,其熔、沸点越高,反之则越低.
题中,4种离子化合物,氯离子半径是相同的,由于r(Li+)<r(Na+)<r(K+)<r(Cs+),故离子键的强弱依次是LiCl>NaCl>KCl>CsCl,故氯化锂熔点最高.
本题难度:简单
3、选择题 下列离子方程式正确的是?(?)
A.用醋酸除去水垢:
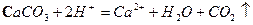
B.苯酚与碳酸钠反应: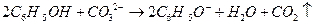
C.苯酚钠溶液中通入少量CO2: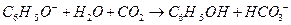
D.乙酸乙酯与氢氧化钠溶液反应: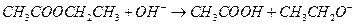
参考答案:C
本题解析:A项,醋酸属于弱酸,不能拆成离子形式,正确写法是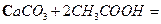
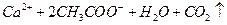 ;B项,苯酚属于弱酸,酸性弱于H2CO3,所以该反应不能发生;D项,正确写法是
;B项,苯酚属于弱酸,酸性弱于H2CO3,所以该反应不能发生;D项,正确写法是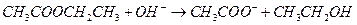 。
。
本题难度:简单
4、选择题 下列说法正确的是
A.4.6?g?Na完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1?NA(设NA表示阿伏加德罗常数的值)
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.在2Cu2S+2H2SO4+5O2═4CuSO4+2?H2O中,Cu2S发生还原反应
D.Al、Fe、Cu对应的氧化物均为碱性氧化物
参考答案:A
本题解析:分析:A.氧化钠和过氧化钠中阴阳离子个数比都是1:2,根据钠离子计算阴离子个数;
B.钠元素的焰色反应呈黄色,对钾元素的焰色反应造成干扰;
C.得电子化合价降低的反应物发生还原反应;
D.氧化铝是两性氧化物.
解答:A.氧化钠和过氧化钠中阴阳离子个数比都是1:2,4.6g钠的物质的量是0.2mol,4.6gNa完全转化成Na2O和Na2O2的混合物,钠离子的物质的量是0.2mol,所以生成物中阴离子总数为0.1?NA(设NA表示阿伏加德罗常数的值),故A正确;
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液可能是钠盐溶液,也可能是钾盐溶液,要确定是否是钾盐溶液,要透过蓝色的钴玻璃滤去黄光的干扰,故B错误;
C.该反应中,Cu2S的铜、硫元素都失电子发生氧化反应,故C错误;
D.铁、铜的氧化物是碱性氧化物,氧化铝既能和酸反应又能和强碱反应,所以是两性氧化物,故D错误;
故选A.
点评:本题考查了物质的构成、焰色反应、氧化还原反应等知识点,知道焰色反应的操作方法,明确过氧化钠中阴离子是过氧根离子而不是氧离子,为易错点.
本题难度:简单
5、选择题 某溶液中含有HCO3—、SO32—、SiO32—、Cl—等四种离子若向其中加入某种试剂后,发现溶液中仅有HCO3—和SO32—离子的浓度大量减少。则加入的试剂可能是
A.盐酸
B.过氧化钠
C.双氧水
D.氯化钡溶液
参考答案:B
本题解析:
正确答案:B
加Na2O2发生的反应,2Na2O2+2H2O=4NaOH+O2,HCO3―+OH―=CO32― ,2SO32―+O2=2SO42―, HCO3—和SO32—离子的浓度大量减少。
A加盐酸后,HCO3—、SO32—、SiO32—均减少;C、加双氧水仅(SO3)2—减少;D、加BaCl2后,SO32—、SiO32—减少。
本题难度:简单