时间:2021-06-11 06:32:06
1、选择题 某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为1∶1∶6。下列有关该溶液的判断正确的是( )
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀氢氧化钠溶液,立即出现白色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为1
D.向该溶液中加入过量铁粉,只发生置换反应
2、选择题 下列离子化合物,熔点最高的是
A.氯化钠
B.氯化钾
C.氯化锂
D.氯化铯
3、选择题 下列离子方程式正确的是?(?)
A.用醋酸除去水垢:
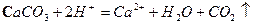
B.苯酚与碳酸钠反应: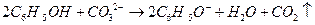
C.苯酚钠溶液中通入少量CO2: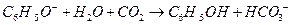
D.乙酸乙酯与氢氧化钠溶液反应: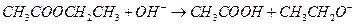
4、选择题 下列说法正确的是
A.4.6?g?Na完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1?NA(设NA表示阿伏加德罗常数的值)
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.在2Cu2S+2H2SO4+5O2═4CuSO4+2?H2O中,Cu2S发生还原反应
D.Al、Fe、Cu对应的氧化物均为碱性氧化物
5、选择题 某溶液中含有HCO3—、SO32—、SiO32—、Cl—等四种离子若向其中加入某种试剂后,发现溶液中仅有HCO3—和SO32—离子的浓度大量减少。则加入的试剂可能是
A.盐酸
B.过氧化钠
C.双氧水
D.氯化钡溶液