时间:2021-06-11 06:25:28
1、选择题 若NA代表阿伏加德罗常数的值,以下说法正确的是
A.3.6g重水含有的电子数为2NA
B.常温常压下,22.4升氯气所含的原子数目为2NA
C.常温常压下,活泼金属从盐酸中置换出1mol H2,发生转移的电子数为2NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为2NA
参考答案:C
本题解析:略
本题难度:一般
2、选择题 实验室里用一氧化碳还原氧化亚铁、氧化铁、四氧化三铁组成的混合物,并将生成的气体通入足量的澄清石灰水中,最后测得生成的铁和碳酸钙的质量比为21:50,则这种混合物中氧化亚铁、氧化铁、四氧化三铁的物质的量之比不可能是
A.1:2:1
B.3:2:1
C.7:7:9
D.1:1:1
参考答案:AD
本题解析:碳酸钙的物质的量等于一氧化碳生成二氧化碳的物质的量,即氧化物中的氧原子的物质的量。所以,Fe:O=21/56:50/100=3:4。则氧化亚铁和氧化铁组成3:4则氧化亚铁:氧化铁=1:1,四氧化铁为任意。因而答案为A、D
本题难度:一般
3、选择题 下列说法中正确的是
A.1mol/L的NaCl溶液是指此溶液中含有1mol NaCl
B.从1 L 0.5 mol/L,的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.05 mol/L,
C.25℃、1atm时,1molCl2的体积约为22.4L
D.50ml、l mol/L的CaCl2溶液和100ml、2 mol/L的NaCl溶液中的Cl-的物质的量浓度相同.
参考答案:D
本题解析:略
本题难度:一般
4、填空题 实验室用Na2CO3·10H2O晶体配制0.02 mol/L的Na2CO3溶液480 mL。
(1)① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ;
② 实验中两次用到玻璃棒,其作用分别是 、 。
(2) 应用托盘天平称取Na2CO3·10H2O晶体的质量为: g。
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠晶体失去了部分结晶水; ②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠; ④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水。
其中引起所配溶液浓度:a.偏高的有 ;
b.偏低的有 ;
c.无影响的有 。
参考答案:(1)①500 mL容量瓶(1分)、胶头滴管(1分) ② 搅拌,加快固体溶解(1分) 引流(1分)
(2)2.9 (2分) (3)a.①⑤ b.②③⑥ c. ④(每个序号1分)
本题解析:(1)根据操作步骤选取实验仪器;配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,固体药品一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少500 mL容量瓶、胶头滴管;② 实验中两次用到玻璃棒,其作用分别是搅拌,加快固体溶解、 引流。
(2)m=nM=CVM=0.02mol/L×0.5L×286g/mol=2.9g。
(3)①碳酸钠晶体失去了部分结晶水,导致称量溶质碳酸钠的质量增大,配制溶液的浓度偏高;②用“左码右物”的称量方法称量晶体导致称量溶质的质量增小,配制溶液的浓度偏低;③碳酸钠晶体不纯,其中混有氯化钠,导致碳酸钠的物质的量偏小,配制溶液的浓度偏低;④容量瓶未经干燥就使用不影响溶质的物质的量,也不影响溶液的体积,所以对配制的溶液浓度无影响;⑤定容时俯视液面,所配溶液的体积偏小,浓度偏高;⑥摇匀后发现液面低于刻度线再加水,所配溶液的体积偏大,浓度偏低;综上所述,偏高的为:①⑤,偏低的为:②③⑥,无影响的为:④。
考点:考查一定物质的量浓度溶液的配制。
本题难度:一般
5、选择题 下列说法正确的是(设阿伏加德罗常数的数值为6.02×1023)(? )。
A.在标准状况下,22.4 L苯所含分子数目为6.02×1023
B.1 mol/L K2SO4溶液所含K+数目为2×6.02×1023
C.在常温常压下,16 g 02和03的混合气体所含原子数目为6.02×1023
D.2.4 g Mg与足量盐酸完全反应时,失去电子数目为O.1x 6.02×1023
参考答案:C
本题解析:A:标准状况下苯为液体,不符合气体的摩尔体积,不正确
B:溶液没有体积,无法计算其中的微粒数目,不正确
C:混合气体均由氧元素组成,故16 g混合气体含有的氧原子一定为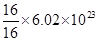 个,正确
个,正确
D:由Mg-2e-=Mg2+可知,2.4 g Mg与足量盐酸完全反应时,失去电子数目为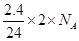 ,即O.2x 6.02×1023
,即O.2x 6.02×1023
答案为C
本题难度:一般