时间:2021-06-11 06:25:28
1、计算题 (8分)一定量的液态化合物XY2,在一定量O2中恰好完全反应:
XY2(液)+ 3O2(气)= XO2(气)+ 2YO2(气)。冷却后在标准状况下,测得生成物的体积为672mL,密度为2.56g/L。则:
(1)反应前O2在标准状况下的体积是 mL;
(2)化合物XY2的摩尔质量是 。
参考答案:(1)672 (2)76g/mol
本题解析:
试题解析:(1)一定量的液态化合物XY2,在一定量O2中恰好完全反应:XY2(液)+3O2(气)=XO2(气)+2YO2(气);反应前后气体体积不变,参加反应的氧气体积和生成物的气体体积相同,所以冷却后在标准状况下,测得生成物的体积为672mL,判断反应的氧气体积为672mL;(2)在标准状况下氧气物质的量=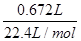 =0.03mol;根据化学方程式定量关系:XY2(液)+3O2(气)=XO2(气)+2YO2(气);可以得到反应的XY2物质的量为0.01mol;依据化学反应质量守恒,生成物质质量=0.672L×2.56g/L≈1.72g;反应的氧气质量=0.03mol×32g/mol=0.96g;所以XY2的质量=1.72g-0.96g=0.76g; XY2的摩尔质量=
=0.03mol;根据化学方程式定量关系:XY2(液)+3O2(气)=XO2(气)+2YO2(气);可以得到反应的XY2物质的量为0.01mol;依据化学反应质量守恒,生成物质质量=0.672L×2.56g/L≈1.72g;反应的氧气质量=0.03mol×32g/mol=0.96g;所以XY2的质量=1.72g-0.96g=0.76g; XY2的摩尔质量=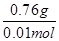 =76g/mol。
=76g/mol。
考点:化学方程式的有关计算
本题难度:一般
2、选择题 设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,1.7gH2O2中含有的电子数为0.9NA
B.1 mol.L-1CuCl2溶液含有2NA个Cl-
C.1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子
D.标准状况下,2.24L戊烷所含分子数为0.1NA
参考答案:A
本题解析:A.n(H2O2)=1.7g÷34g/mol=005mol.每摩尔的H2O2中含有18摩尔的电子,所以1.7gH2O2中含有的电子数为0.9NA。正确。B.只知道浓度却体积无法计算。错误。C.Na 是+1价的金属,所以1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子。错误。D.标准状况下,戊烷是液体,所以不能使用气体摩尔体积。错误。
本题难度:一般
3、选择题 若20 g密度为d g·cm-3的硝酸钙溶液中含1 g Ca2+,则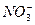 的浓度为(?)
的浓度为(?)
A.d/400 mol·L-1
B.20/d mol·L-1
C.2.5d mol·L-1
D.1.25d mol·L-1
参考答案:C
本题解析:根据电解质溶液中阴、阳离子所带的电荷总数相等。则有:
n(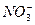 )×1=n(Ca2+)×2,设c(
)×1=n(Ca2+)×2,设c(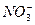 )="M" mol·L-1,则M×
)="M" mol·L-1,则M×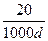 ×1=
×1=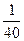 ×2,所以M="2.5d" mol·L-1。
×2,所以M="2.5d" mol·L-1。
本题难度:简单
4、选择题 设NA为阿伏加德罗常数,下列说法中,正确的是 ( )
A.2.4 g金属镁所含电子数目为0.2 NA
B.16 g CH4所含原子数目为NA
C.17 g NH3 所含氢原子数目为4 NA
D.18 g水所含分子数目为NA
参考答案:D
本题解析:镁原子中含有12个电子,2.4g镁的物质的量为0.1mol,含有12x0.1molxNA mol-1=1.2NA,A错误;16g甲烷的物质的量为1mol,所含分子数为NA,原子数为5NA,B错误;17 g NH3 的物质的量为1mol,含有3NA,C错误;18g水的物质的量为1mol,所含分子数为NA,D正确;答案选D.
考点:阿伏伽德罗常数
本题难度:一般
5、简答题 将?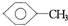
?和C3H5(OH)3(甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是______:
A.40%?B.35%?C.30%?D.无法计算.
参考答案:
的分子式为C7H8,C3H5(OH)3的分子式为C3H8O3,二者相对分子质量都为92,且含氢原子数相同,
则H元素的质量分数为892×100%=8.7%,
氧元素的质量分数为:1-C%-H%=1-51.3%-8.7%=40%,
故答案为:A.
本题解析:
本题难度:一般