时间:2021-06-11 06:20:08
1、填空题 图1是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜是“阳离子交换膜”,它有一特殊的性质——只允许阳离子通过而阻止阴离子和气体通过。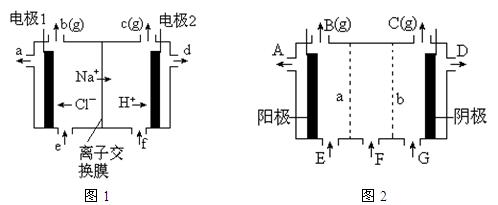
⑴、工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为?▲?,?▲?。
⑵、如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是?▲?。
,该钡试剂可以是?▲?。
A.Ba(OH)2?B.Ba(NO3)2?C.BaCl2?
⑶、为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为?▲?。
A.先加NaOH,后加Na2CO3,再加钡试剂?
B.先加NaOH,后加钡试剂,再加Na2CO3?
C.先加钡试剂,后加NaOH,再加Na2CO3
⑷、电解后得到的氢氧化钠溶液从?▲?口流出,b口排出的是?▲?气体,电极1应连接电源的
?▲?极(填“正”或“负”极);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是?▲?。
⑸、图2是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①、a为?▲?(填“阳”、“阴”)离子交换膜。
②、阳极的电极反应式是?▲?。
③、从D、E口流出或流进的物质的化学式分别为?▲?,?▲?。
参考答案:⑴、Ca2++CO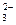 =CaCO3↓? Mg2++2OH-=Mg(OH)2↓
=CaCO3↓? Mg2++2OH-=Mg(OH)2↓
⑵、A C?
⑶、B C
⑷、d; Cl2; 正; 增强溶液的导电性,又不影响NaOH纯度。
⑸、①、阴; ②、4OH—4e- ="=" 2H2O + O2↑ ③、NaOH ,H2O(加少量稀硫酸)。
本题解析:略
本题难度:一般
2、选择题 下列关于化工生产原理的叙述中,均符合目前工业生产实际的是
A.氯碱工业中,氢氧化钠在电解槽的阴极区产生
B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸
C.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸
D.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,总体上提高了氨的产率
参考答案:AD
本题解析:A、电解氯化钠溶液,正确;B、氯气和氢气混合在光照条件下会爆炸,危险,错误;C、三氧化硫在吸收塔内被水吸收制成浓硫酸,易形成酸雾,错误;D、合成氨是可逆反应,有平衡,正确。
本题难度:一般
3、选择题 有关化工生产原理说法正确的是( )
A.工业上制粗硅:SiO2 + C Si + CO2↑
Si + CO2↑
B.海水提镁的主要步骤为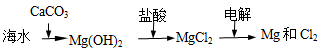
C.海水提溴原理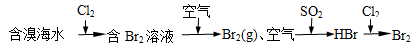
D.硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器
参考答案:C
本题解析:
正确答案:C
A、SiO2+C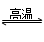 2CO↑+Si
2CO↑+Si
B 电解MgCl2的水溶液得不到Mg,应电解无水MgCl2
C 正确
D、氯碱工业的电解槽没有热交换器
本题难度:简单
4、填空题 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol ? N2(g)+3H2(g)
? N2(g)+3H2(g) 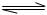 2NH3(g);△H= -92.4kJ/mol
2NH3(g);△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H= -483.6kJ/mol
氨气经催化氧化生成一氧化氮气体和水蒸气反应的热化学方程式为?。
(2)在容积固定的密闭容器中发生上述氨气的催化氧化反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| 起始 | ? 0.8 | ? 1.6 | ? 0 |
| 第2min | ? 0.6 | ? a | ? 0.2 |
| 第4min | ? 0.3 | ? 0.975 | ? 0.5 |
| 第6min | ? 0.3 | ? 0.975 | ? 0.5 |
| 第8min | ? 0.54 | ? 0.9 | ? 0.56 |
参考答案:(1)4NH3(g)+5O2(g) 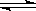 4NO(g)+6H2O (g);ΔH=-905kJ·mol—1?(3分)
4NO(g)+6H2O (g);ΔH=-905kJ·mol—1?(3分)
(2)①可增大NH3的转化率(2分)? ②0.1875 mol/(L·min) (2分)?
③使用催化剂(2分)?升高温度(2分) ?
④增加NH3的浓度,(2分)
因为6min后平衡向正反应方向移动,而NH3的浓度又增大了。(1分)
本题解析:略
本题难度:一般
5、填空题 (8分)碘化钠是无色立方晶体或白色结晶性粉末,具有还原性,可被一般氧化剂氧化。在医药上用作祛痰剂和利尿剂。也可用作照相胶片感光剂,碘的助溶剂。工业上用铁屑还原法来制备碘化钠,同时可得到副产品,该副产品常用作红色油漆和涂料。工艺流程如下: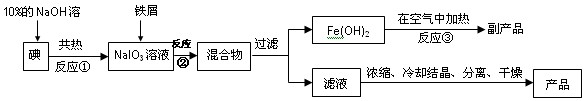
(1)反应①的还原产物为?;反应②中的氧化剂是?。
(2)判断反应①中的碘是否已完全转化的具体操作方法是?。
(3)反应②的离子方程式为?;
(4)将滤液浓缩、冷却、分离、干燥和包装过程中,都需要注意的问题是?。
参考答案:(1)NaI? NaIO3 (2分)
(2)取少量反应混合液于试管中并滴入几滴淀粉溶液,若溶液未变蓝色,证明碘已完全转化;如果溶液变蓝,则说明碘没有转化完全(2分) (3)3Fe+IO3-+3H2O 3Fe(OH)2↓+I-?(2分)
(3)3Fe+IO3-+3H2O 3Fe(OH)2↓+I-?(2分)
(4)防止NaI被空气氧化(2分)
本题解析:略
本题难度:一般