时间:2021-06-11 06:20:08
1、填空题 (14分)?硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为?4FeS2 + 11O2
该反应中氧化剂和氧化产物之比为?;标准状态下得到4.48升SO2 时,一共转移了?mol e-。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是?。(每空2分)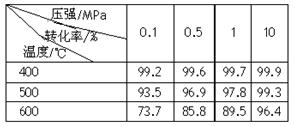
A.400-500℃ 0.1 MPa
B.400℃10 MPa
C.500℃10 MPa
D.400-500℃1 MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:?。若在该条件下将2 mol SO2放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为??(用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为??。(每空2分)
参考答案:(14分)
(1)11:10? 1.1? mol e-。(每空3分)?(2)B(2分)
(3)SO2(g)+1/2O2(g) ="=?"  ?SO3(g)?△H="-QKJ/mol?" Q2/2Q1?。(每空2分)
?SO3(g)?△H="-QKJ/mol?" Q2/2Q1?。(每空2分)
(4)1/ 9?。(每空2分)
本题解析:略
本题难度:一般
2、填空题 (14分)近年来,随着我国经济的快速发展,对电力的需求越来越高,这也促进了我国电力工业高速发展,但我国电力结构中,火电比重非常大,占发电装机总容量的75%以上,且火电比重还在逐年上升。火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH1=-574kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH2=-1160kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为:?。
(2)脱碳。将CO2转化为甲醇的热化学方程式为: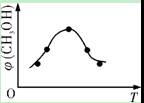
CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH3
CH3OH(g)+H2O(g);ΔH3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的ΔH3 ?0(填“>”、“<”或“=”)。
②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。下列说法正确的是 ? (填字母代号)。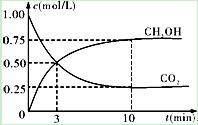
A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol·L-1
B.0~10min内,氢气的平均反应速率为0.075mol/(L·min)
C.达到平衡时,氢气的转化率为0.75
D.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇碱性燃料电池工作时负极的电极反应式可表示为 ? 。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1∶1,则该反应的化学方程式为:? 。
(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为: ? ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中:c(Na+)+c(H+) c(NO)+c(OH-)(填写“>”“=”或“<”)。
参考答案:
(1)CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g);ΔH=-867kJ/mol(3分)
(2)①<(2分)?②CD(2分)?③CH3OH+8OH--6e-===CO32-+6 H2O(3分)
(3)12NH3+3O2+4SO2+4NO2+6H2O===4(NH4)2SO4+4NH4NO3(3分)
(4)NH+H2O NH3·H2O+H+(3分)?<(2分)
NH3·H2O+H+(3分)?<(2分)
本题解析:略
本题难度:一般
3、填空题 工业酒精是含水约4%的液态乙醇。向工业酒精中加入生石灰,会发生如下的化学反应且生成物不溶于乙醇。? CaO + H2O =Ca(OH)2
要在实验室中将工业酒精转化为无水酒精,请回答下列问题:
(1)下列做法中,最不可取的是(填写代号)?
加入过量的生石灰后过滤
加入过量的生石灰后蒸馏
加入过量的生石灰后分液
(2)为了防止暴沸应加入??。冷凝管中水从?口进,从??口出。
(3)用酒精灯作热源,在加热的过程中要适当调整酒精灯的上下或左右的位置,目的是 ?。
(4)在你选择需要加热的实验方法中,需用的玻璃仪器除酒精灯以外,还有?
?(仪器尽可能答完整)
参考答案:(1)AC?(2分)?
(2) 几粒沸石?下;上?(每空1分)
(3)使蒸馏烧瓶内的支管口处保持某一恒温?(2分)?
(4) 温度计、蒸馏烧瓶、冷凝管、锥形瓶、牛角管?(5分)
本题解析:略
本题难度:简单
4、填空题 (15分)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制三氯化铬的流程如下: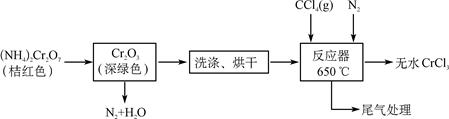
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净________________。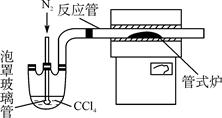
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜的加热方式是________。
(3)用右图装置制备CrCl3时,反应管中发生的主要反应为Cr2O3+3CCl4===2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为①____________________________;
②____________________________。
(4)Cr对环境会造成严重的污染,废水中的Cr3+可用石灰乳进行沉降,写出沉降的离子方程式________________________
参考答案:(1)最后一次洗涤的流出液呈无色(3分)
(2)水浴加热(并用温度计指示温度)(3分)
(3)赶尽体系中的氧气(3分) 鼓气使反应物进入管式炉中进行反应(3分)
(4)2Cr3++3Ca(OH)2=2Cr(OH)3↓+3Ca2+(3分)
本题解析:(1)因为(NH4)2Cr2O7显桔红色,所以可以提供颜色来判断。
(2)因为CCl4沸点为76.8 ℃,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量。
(3)因为三氯化铬易升华,在高温下能被氧气氧化,所以为了防止氧化需要排进装置中的空气,同时又为了将反应物完全进入管式炉中反应,以提高其利用率。
(4)因为Cr3+易和OH-结合生成难溶性的沉淀,故反应的方程式为2Cr3++3Ca(OH)2=2Cr(OH)3↓+3Ca2+。
本题难度:一般
5、选择题 符合实际并用于工业生产的是? ( )。
A.CO2通入氢氧化钠溶液中制Na2CO3
B.H2和Cl2光照制HCl
C.Cl2通入澄清石灰水中制漂白粉
D.用硫黄制硫酸
参考答案:D
本题解析:制Na2CO3的方法是侯氏制碱法,A项错。H2和Cl2的混合气体光照会引起爆炸,工业制HCl的方法是使Cl2在H2中燃烧,B项错。澄清石灰水浓度太小,制取漂白粉的方法是向石灰乳中通Cl2,C项错。
本题难度:一般