时间:2021-06-11 06:05:29
1、选择题 下列判断正确的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.晶体中一定存在化学键
D.正四面体分子中键角可能是109°28′或60°
参考答案:D
本题解析:A、镁的3s轨道电子处于全充满状态,稳定性强,所以第一电离能大于铝的,A不正确;B、氟没有正价,B不正确;C、稀有气体形成的晶体中不存在化学键,C不正确;D、正四面体分子中键角可能是109°28′例如甲烷等,或60°例如白磷,D正确,答案选D。
本题难度:一般
2、选择题 下列表示正确的是
[? ]
A. CO2的比例模型:
B. 铝离子的结构示意图: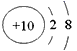
C. 次氯酸的结构式: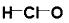
D. 甲基的电子式: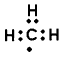
参考答案:D
本题解析:
本题难度:简单
3、选择题 关于化学键的下列叙述中正确的是
[? ]
A.离子化合物不可能含共价键
B.共价化合物可能含离子键
C.含离子键的化合物是离子化合物
D.含共价键的化合物是共价化合物
参考答案:C
本题解析:
本题难度:简单
4、简答题 有A、B、C、D、W五种元素.W的原子序数为29,其余的均为短周期主族元素;其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个未成对的电子;C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐;D原子核内的质子数与中子数相等,能与B形成DB2、DB3常见化合物.根据以上条件,回答下列问题:
(1)推断元素名称:A______.
(2)C元素的氢化物的空间构型为______,分子中的化学键______(填“有”或“无”)极性,其分子为______分子(填“极性”或“非极性”).
(3)比较A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示),A、B、C三种元素的氢化物的沸点高低______(用化学式表示).
(4)写出D元素原子基态时的电子排布式______,其在元素周期表中的位置______.
(5)W元素+2价离子的水溶液呈现天蓝色,是该离子与水分子通过______键形成的______(填化学式)而显示出的颜色.
参考答案:有A、B、C、D、W五种元素.W的原子序数为29,则W为Cu元素;其余的均为短周期主族元素,C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐,则C为N元素;A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,则外围电子排布为2s22p2,则A为碳元素;B原子最外层中有两个未成对的电子,其最外层电子数不能为4,则外围电子排布为2s22p4,故B为氧元素;D原子核内的质子数与中子数相等,能与O元素形成DO2、DO3常见化合物,则D为硫元素,
(1)由上述分析可知,A为碳,故答案为:碳;
(2)C元素的氢化物为NH3,N原子成3个N-H键、含有1对孤对电子,采取SP3杂化,为三角锥型结构,N-H为极性键,分子不对称,为极性分子;
故答案为:三角锥型;有;极性;
(3)同周期自左而右第一电离能呈增大趋势,N原子2p能级有3个电子,处于半满稳定状态,电子能量降低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;常温下水为液体,沸点最高,氨气、甲烷常温下为气体,氨气分子中存在氢键,沸点比甲烷高,故沸点H2O>NH3>CH4,
故答案为:N>O>C;H2O>NH3>CH4;
(4)S元素原子核外有16个电子,基态时的电子排布式1s22s22p63s22p4,处于元素周期表中第三周期第ⅥA族,
故答案为:1s22s22p63s22p4;第三周期第ⅥA族;
(5)Cu2+与水分子通过配位键形成[Cu(H2O)4]2+而显示出的颜色,故答案为:配位键;[Cu(H2O)4]2+.
本题解析:
本题难度:简单
5、选择题 下列说法正确的是?
[? ]
①离子化合物一定含离子键,也可能含极性键或非极性键 ②共价化合物一定含共价键,也可能含离子键 ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤由分子组成的物质中一定存在共价键 ⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ ?
B.②④⑥ ?
C.②③④ ?
D.①③⑥
参考答案:D
本题解析:
本题难度:简单