时间:2021-06-11 06:05:29
1、选择题 下列分子结构中的原子最外层电子都能满足8个电子稳定结构的是
[? ]
A.CH4
B.SF6
C.BF3
D.CCl4
2、选择题 下列叙述中正确的是( )
A.分子晶体中都存在共价键
B.F2、Cl2、Br2、I2的熔、沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
3、选择题 下列说法中正确的是
A.共价化合物中一定不含有离子键,离子化合物中可能含有共价键
B.一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3
C.铁质器件附有铜质配件,在接触处易生铁锈
D.共价化合物都是由分子构成的,其熔沸点较低
4、选择题 关于配位键的形成,下列说法正确的是
[? ]
A.提供电子对的原子一般要有孤对电子
B.接受电子对的原子一般要有空轨道
C.任意两个原子间都可以形成配位键
D.配位键一般是单键,和普通单键性质不同
5、选择题 X、Y、Z、M、W为五种短周期主族元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的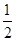 。下列说法正确的是
。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线形共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由Y、Z、M三种元素形成的化合物中只含有共价键