时间:2021-06-11 06:02:37
1、选择题 25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )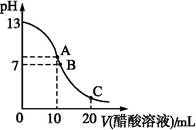
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
参考答案:A
本题解析:在A点是20 mL 0.1 mol·L-1 NaOH溶液和10 mL 0.2 mol·L-1醋酸溶液恰好反应完全,生成的醋酸钠中的醋酸根离子水解使溶液呈碱性,离子浓度的关系应该为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A项错误;B点时溶液为中性,c(OH-)=c(H+),由电荷守恒可得c(CH3COO-)=c(Na+),B项正确;在C点,CH3COOH过量,以CH3COOH电离为主,溶液呈酸性,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-),C项正确;在C点由物料守恒可得c(CH3COO-)+c(CH3COOH)=2c(Na+),故D项正确。
本题难度:一般
2、填空题 科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。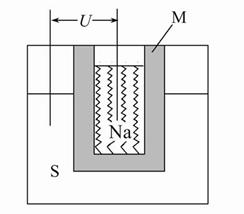
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
参考答案:(1)2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ CS2(或热的NaOH溶液)
2CH3CH2ONa+H2↑ CS2(或热的NaOH溶液)
(2)xS+2e-=Sx2- (或2Na++xS+2e-=Na2Sx) 导电和隔离钠与硫 4.5
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) 减小 2S2-+O2+2H2O=4OH-+2S↓
本题解析:(2)正极的电极反应式为:xS+2e-= Sx2-,M的作用:一是导电,二是因钠与硫易反应,故它起到隔离作用;钠高能电池中负极为钠,有23 g钠消耗释放1 mol e-,则207 g钠消耗时转移207/23 mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池中铅是负极,207 g铅消耗时转移2 mol e-,故钠硫电池的理论放电量是铅蓄电池的(207/23)∶2=4.5倍。
(3)根据电离与水解的知识可判断:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),加入少量固体CuSO4后,溶液中发生离子反应:Cu2++S2-=CuS↓,由于c(S2-)降低,故由S2-水解产生的OH-量减小,c(OH-)变小,c(H+)变大,溶液的pH减小;Na2S溶液长期放置所发生的化学反应方程式为2Na2S+O2+2H2O=4NaOH+2S↓,故离子方程式为2S2-+O2+2H2O=4OH-+2S↓。
本题难度:困难
3、选择题 分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④Ca(HCO3)2 ⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是( )
A.①②③
B.①③
C.③④
D.③
参考答案:B
本题解析:①CuSO4是难挥发的强酸弱碱盐,溶液蒸干得到的任然是该物质本身。正确。②Na2O2放入水中发生反应得到的是NaOH。把溶液蒸干得到的是NaOH。错误。③NaCl是强酸强碱盐,在溶液中不水解。溶液蒸干得到的NaCl.正确。④Ca(HCO3)2是强碱弱酸盐,加热时水解产生的弱酸H2CO3会与碱发生反应Ca(OH)2得到正盐CaCO3。CaCO3难溶于水,所以把溶液蒸干得到的是CaCO3。错误。⑤FeCl3该盐水解FeCl3+3H2O  Fe(OH)3+3HCl产生的HCl有挥发性,会随着水分的蒸发而挥发,促使盐继续水解,最终得到的是Fe(OH)3。错误。
Fe(OH)3+3HCl产生的HCl有挥发性,会随着水分的蒸发而挥发,促使盐继续水解,最终得到的是Fe(OH)3。错误。
考点:考查盐溶液蒸干得到的固体与水解的规律的知识。
本题难度:一般
4、选择题 已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3
参考答案:
本题解析:
本题难度:困难
5、选择题 下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
参考答案:D
本题解析:
试题解析:PH相等的CH3COONa.NaOH.Na2CO3三种溶液:强碱NaOH中OH-完全电离,其余是盐类水解呈碱性,则相同PH下,c(NaOH)最小,谁弱谁水解,比较醋酸和碳酸:醋酸的酸性强于碳酸,则水解程度相反:醋酸根<碳酸根,在相同浓度的CH3COONa和Na2CO3下,水解程度大的,氢氧根浓度大,PH高,则在同等PH下,c(CH3COONa)>c(Na2CO3)>c(NaOH),故A错误;若组成该盐的酸为强酸,溶液的PH值应为1,实际上溶液的PH为4,说明该酸为弱酸,盐为强碱弱酸盐,电离程度大于水解程度,导致溶液呈酸性;电离:HA-?H++A2-;水解:HA-+H2O?H2A+OH-,A2-+H2O?HA-+OH-少,c(A2-)>c(H2A)则,溶液中存在水的电离,所以,c(H+)>c(A2-),电离与水解程度都不大,所以,c(HA-)最大,c(HA-)>c(H+)>c(A2-)>c(H2A),故B错误;等体积、等物质的量浓度的NaX和弱酸HX混合,若c(H+)>c(OH—),则HX的电离程度大于NaX的水解程度,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故C错误;pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,醋酸过量,溶液呈酸性,滴入石蕊溶液呈红色,故D正确。
考点:盐类水解、离子浓度大小比较
本题难度:一般