时间:2021-06-11 06:02:37
1、填空题 (9分)某二元酸H2A在水中的电离方程式:H2A==H++HA-;HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显 (填“酸性”、“中性”或“碱性”)。理由是
___________________________________________(用离子方程式表示)
(2)在0.1 mol/L的Na2A溶液中,下列离子浓度关系不正确的是 。
A.c(A2-)+c(HA-)=0.1 mol/L
B.c(H+)=c(OH-)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3) 0.1 mol/LNaHA溶液中各种离子浓度由大到小的顺序是 。
参考答案:(1)碱性 A2-+H2O HA-+OH- (2)B、C
HA-+OH- (2)B、C
(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题解析:(1)根据电离方程式可以看出H2A的第一步电离是完全的,第二步电离是不完全的,所以Na2A溶液可以水解呈碱性,水解方程式为A2-+H2O HA-+OH-。
HA-+OH-。
(2)由于H2A的第一步电离是完全的,所以溶液中不存在H2A分子,则A是正确的。根据电荷守恒c(H+)+ c(Na+)=c(OH-)+c(HA-)+2c(A2-),物料守恒c(Na+)=2c(A2-)+2c(HA-),可知c(OH-)= c(H+)+c(HA-),所以B、C错误,D正确。
(3)NaHA溶液中发生的电离反应有NaHA=Na++HA-,HA- H++A2-,HA-没有水解反应,所以溶液显酸性,溶液中的离子浓度大小关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
H++A2-,HA-没有水解反应,所以溶液显酸性,溶液中的离子浓度大小关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
考点:弱电解质的电离
点评:本题难度较大,主要考查学生分析问题的能力。
本题难度:困难
2、选择题 浓度为0.1 mol/L的某物质的水溶液,且pH=5.1,则此物质应是下列中的
A.H2SO4
B.NH4Cl
C.NaHCO3
D.CH3COONa
参考答案:B
本题解析:只有A选项和B选项显酸性,但是A选项不符合pH=5.1的条件.
本题难度:困难
3、填空题 (10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示): ;
(2)氯化铝水溶液呈 性,(填“酸”、“中”、“碱”)性,原因是(用离子方程式表
示): ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)已知MgCl2·6H2O晶体在空气中加热时,释放部分结晶水,同时生成Mg(OH)Cl(碱式氯化镁)或生成MgO。下列是关于MgCl2·6H2O的综合应用:
请回答下列问题:
①在上图的括号内应填的是在_______________环境中加热。
②Mg(OH)2固体存在如下溶解平衡:Mg(OH)2(固)  Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(请填出两种不同类别的物质)_____________________________________________________ 有利于Mg(OH)2溶解。
③已知AnBm的离子积=c (Am+) n ·c (Bn-) m,式中c (Am+) n和c (Bn-) m表示离子的物质的量浓度,在室温时若测得Mg(OH)2饱和溶液的pH值为11,其离子积为___________________。
参考答案:(1)酸, Ag++ H2O 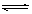 AgOH + H+
AgOH + H+
(2)酸, Al3++3H2O 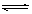 Al(OH)3+3H+, Al2O3 ;
Al(OH)3+3H+, Al2O3 ;
(3) ①HCl气流 ②酸、水、酸性气体、饱和NH4Cl等(任选两种)(每空1分)
③5×10-10(2分)
本题解析:(1)AgNO3是强酸弱碱盐,水解显酸性。
(2)氯化铝也是强酸弱碱盐,水解显酸性。铝离子水解生成氢氧化铝和氯化氢,水解吸热,加热促进水解。同时氯化氢的挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝。
(3)氯化镁水解显酸性,所以要得到氯化镁晶体,在加热时需要防止水解,因此在硫化氢的气流中加热即可。根据氢氧化镁的溶解平衡可知,要促进溶解,就必须使平衡向正反应方向移动。所以可以通过消耗OH-或镁离子来实现。根据离子积常数的概念可知,离子积常数是电离出的离子的浓度的幂之积,Mg(OH)2饱和溶液的pH值为11,则OH-的浓度为10-3mol/L,则镁离子浓度为5×10-4mol/L,所以氢氧化镁的离子积常数为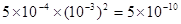 。
。
本题难度:困难
4、填空题 (每空2分,共12分)
I、(1)已知1 g H2S气体完全燃烧,生成液态水和二氧化硫气体,放出17.24 kJ热量,请写出H2S气体燃烧热的热化学方程式:
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
II、已知常温下在NaHSO3溶液中c(H2SO3 )<c(SO32-) 且H2SO3的电离平衡常数为: K1=1.5×10-2 K2=1.1×10-7 ;氨水的电离平衡常数为K=1.8×10-2;
(1)则等物质的量浓度的下列五种溶液:①NH3·H2O ②KHSO3③KHCO3 溶液中水的电离程度由大到小排列顺序为
(2)0.1 mol·L-1的NaHSO3溶液中C(H+) C(OH-)(“>”、“<”或“=”):
Ⅲ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)在25 ℃下,向浓度均为0.1 mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol/L时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol/L。此时所得沉淀中________(填“含有”或“不含有”)Al(OH)3。
参考答案:24、I(1)H2S(g)+ 3/2O2(g)=SO2(g)+H2O(l) ΔH="-586.16" kJ·mol-1
(2)N2H4(l)+2H2O2(l)=N2(g)+4H2O (g) ?H="-641.63" KJ/mol II (1)③>②>① (2)>
Ⅲ(1)Al(OH)3 (2)不含有
本题解析:Ⅰ、1 g H2S完全燃烧,放出17.24 kJ的热量,则H2S的燃烧热为:17.24 kJ·g-1×34 g·mol-1="586.16" kJ·mol-1,则H2S燃烧的热化学方程式为H2S(g)+ 3/2O2(g)=SO2(g)+H2O(l) ΔH="-586.16" kJ·mol-1。
(2)0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O (g) ?H="-641.63" KJ/mol
Ⅱ、(1)酸碱抑制水的电离,则氨水中水的电离程度最小,KHSO3溶液显酸性,电离程度大于水解程度,仍对水的电离起抑制作用,但不如氨水抑制的厉害,KHCO3溶液显碱性,对水的电离起促进作用,则溶液中水的电离程度由大到小的排列顺序为③>②>①,(2)根据c(H2SO3 )<c(SO32-)可知在KHSO3溶液中,HSO3-离子的电离程度大于水解程度,所以0.1 mol·L-1的NaHSO3溶液中C(H+)>C(OH-)。
Ⅲ、(1)根据Al(OH)3、Cu(OH)2的溶度积常数,在浓度均为0.1mol/L的AlCl3和CuCl2混合溶液中逐滴加入氨水,要使Al3+沉积,需符合[Al3+][OH-]3=1.1×10-33,[OH-]=2.22×10-11, 要使Cu2+沉积,需符合[Cu2+][OH-]2=2.2×10-20,[OH-]=1.48×10-10,所以Al(OH)3先沉积,(2)铁离子完全沉淀时,[OH-]3=(4.0×10-38)÷(1.0×10-5)=4.0×10-33,则c(Al3+)·c(OH-)3=0.2×4.0×10-33=8×10-34<Ksp[Al(OH)3],所以没有Al(OH)3沉淀。
考点:考查热化学方程式的书写,影响水电离平衡的因素,难溶电解质的沉淀溶解平衡等知识。
本题难度:困难
5、选择题 下列说法中正确的是
A.8NH3(g)+6NO2(g) 7N2(g)+12H2O(g) ΔH<0,则该反应一定能自发进行
7N2(g)+12H2O(g) ΔH<0,则该反应一定能自发进行
B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
C.催化剂可以加快化学反应速率,也能增大化学反应的焓变
D.NH3·H2O溶液加水稀释后,溶液中的值增大
参考答案:A
本题解析:A、该反应为熵增大的反应,且ΔH<0,由混合判据可知,反应一定能自 发进行,正确;B、常温下,pH均为5的盐酸中氢离子浓度较大,对水的电离有抑制作用较强,而氯化铵溶液中铵根离子发生微弱水解,对水的电离影响较小,错误;C、催化剂可以加快化学反应速率,但不能增大化学反应的焓变,错误;故本题选择A。
考点:化学反应进行的方向,水的电离,催化剂的作用,溶液的稀释
本题难度:一般