时间:2021-06-11 06:02:16
1、选择题 下列关于金属的腐蚀叙述正确的是
A.金属在潮湿的空气中腐蚀的实质是M+nH2O=M(OH)n+n/2H2↑
B.金属的化学腐蚀实质是M→Mn+ +ne-,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
2、选择题 下列事实不能用电化学理论解释的是?(?)
A.轮船水线下船壳上装有一定数量的锌块
B.粗锌比纯锌制H2更快
C.镀锌铁比镀锡铁耐用
D.银质奖章长期放置后表面会变暗
3、填空题 (16分)如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。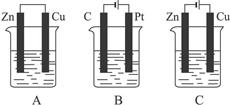
(1)A、B、C三个装置中属于电解池的是_____________。
(2)A池中Cu是? ___?极,A池中总反应的离子方程式为_________________?___。
(3) B池中C电极上发生__? ______? _反应(填“氧化”或“还原”),
B池中总反应的化学方程式为_?。
(4 C池中Cu是__________极,电极反应为?。
反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
4、选择题 在面盆、痰盖等铁制品表面烧制搪瓷的目的是
[? ]
A.防止铁生锈且美观
B.增大厚度防止磨损
C.增大硬度防止撞坏
D.美观和杀菌消毒作用
5、选择题 铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
[? ]
A.正极的电极反应式为:2H++2e-=H2↑
B.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe流向Cu