时间:2021-06-11 05:59:24
1、选择题 X2-与Y+离子都与Ar原子具有相同的核外电子排布,则下列叙述中正确的是( )
A.原子序数X>Y
B.原子半径X<Y
C.X和Y一定同周期
D.X是第IIA族元素,Y是第VIIA族元素
参考答案:X2-与Y+离子都与Ar原子具有相同的核外电子排布,则X的质子数为18-2=16,即X为S,Y的质子数为18+1=19,即Y为K,
A.X的原子序数为16,Y的原子序数为19,则原子序数X<Y,故A错误;
B.X在第三周期,Y在第四周期,周期数等于电子层数,电子层多的原子半径大,则原子半径X<Y,故B正确;
C.X为S,Y为K,一定不在同周期,故C错误;
D.X是第ⅥA族元素,Y是第ⅠA族元素,故D错误;
故选B.
本题解析:
本题难度:一般
2、填空题 已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X基态原子的核外电子分布在3 个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题。
(1)微粒XZ32-的中心原子杂化类型为?化合物YW3的空间构型为?。
(2)R基态原子的电子排布式为?,元素X、Y、Z的第一电离能由大到小的顺序为
?(用元素符号表示)。
(3)一种新型导体晶体的晶胞如右图所示,则该晶体的化学式为?,其中一个Q原子紧邻?个R原子。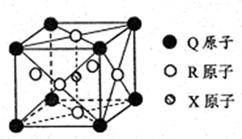
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是?弱酸HXY分子中存在的σ键与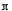 键的数目之比为?。
键的数目之比为?。
参考答案:(16分,每空2分)(1)sp2?三角锥形?(2)1s22s22p63s23p63d84s2或[Ar]3d84s2? N>O>C
(3)MgNi3C? 12?(4)Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-? 1:1
本题解析:X基态原子的核外电子分布在3 个能级,且各能级电子数相等,这说明X的原子序数是2+2+2=6,因此X是碳元素。Z是地壳中含量最多的元素,则Z是氧元素;Y的原子序数介于X与Z之间,所以Y是氮元素。W是电负性最大的元素,所以W是氟元素。元素Q的核电荷数等于Y、W原子的最外层电子数之和,因此Q的原子序数=5+7=12,则Q是镁元素。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,所以R是镍元素。
(1)微粒XZ32-是CO32-,中心原子碳原子含有的孤对电子对数=(4+2-3×2)÷2=0,所以该微粒的空间构型是平面正三角形,则碳原子杂化类型为 sp2杂化;化合物YW3是NF3,根据价层电子对互斥理论可知,中心原子N原子含有的孤对电子对数=(5-3×1)÷2=1,因此NF3分子空间构型为三角锥形结构。
(2)根据构造原理可知,镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以元素X、Y、Z的第一电离能由大到小的顺序为N>O>C。
(3)根据晶胞结构并依据均摊法可知,晶胞Mg原子的个数=8× =1个;Ni原子的个数=6×
=1个;Ni原子的个数=6×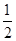 =3个;碳原子的个数=1个,所以其化学式为MgNi3C。由于顶点被周围的8个正方体共用,所以根据晶胞结构可判断一个Mg原子紧邻(3×8)÷2=12个Ni原子。
=3个;碳原子的个数=1个,所以其化学式为MgNi3C。由于顶点被周围的8个正方体共用,所以根据晶胞结构可判断一个Mg原子紧邻(3×8)÷2=12个Ni原子。
4)R的氢氧化物Ni(OH)2能溶于含CN-离子的溶液生成一种配离子[Ni(CN)4]2-,其中CN-是配体,因此反应的离子方程式是Ni(OH)2+4CN-=[Ni(CN)4]2-+2OH-。HCN分子中含有1个碳氢单键和1个碳氮三键,由于单键是σ键,三键是由1个σ键与2个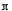 键构成的,所以化合物HCN分子中存在的σ键与
键构成的,所以化合物HCN分子中存在的σ键与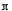 键的数目之比为2:2=1:1。
键的数目之比为2:2=1:1。
本题难度:一般
3、选择题 下列电子式中错误的是( )
A.二氧化碳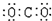
B.氢氧根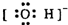
C.钠离子的电子式:Na+
D.氮气分子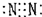
参考答案:A
本题解析:
本题难度:简单
4、选择题 A、B两元素能以共价键结合成分子式为AB2型分子,A、B位于周期表中的族序数可能是(? )
A.ⅠA和ⅤA? B.ⅠA和ⅥA
C.ⅣA和ⅥA? D.ⅡA和ⅦA
参考答案:C
本题解析:AB2型化合物有离子型和共价型,若A为+2价,B为-1价,则为离子型;A为+4价,B为-2价,则为共价型。
本题难度:简单
5、选择题 酸根RO3-所含电子数比硝酸根NO3-的电子数多10。则下列说法正确的是
A.R原子的电子层数比N的电子层数多2
B.R元素的最高正化合价与NO3-中的N的化合价相等
C.R所含电子数比N的电子数多10
D.R和N为同族元素
参考答案:C
本题解析:酸根RO3-所含电子数比硝酸根NO3-的电子数多10。N原子是7号元素,所以,R原子是17号元素。
A 错误,R原子的电子层数比N的电子层数多1
B 错误,R元素的最高正化合价是+7价,NO3-中的N的化合价是+5价,化合价不等。
C 正确。
D 错误,R是第七主族的元素,N 是第五主族元素。
本题难度:一般