时间:2021-06-11 05:56:08
1、实验题 (15分)某研究小组探究SO2和Fe(NO3)3溶液的反应。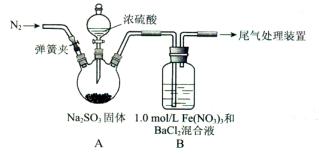
已知:1.0 mol/L的Fe(NO3)3溶液的pH=l
请回答:
(1)装置A中反应的化学方程式是____________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是____________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
观点1.____________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①按观点2,装置B中反应的离子方程式是___________,为证明该观点应进一步检验生成的新物质,其实验操作及现象是__________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)____________。
a.0.1 mol/L稀硝酸?
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
参考答案:(1)Na2SO3+H2SO4(浓) = Na2SO4+ SO2↑+H2O(2分)
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹(2分)
(3)BaSO4(1分)?还原性(1分)
(4)观点1:SO2和Fe3+、酸性条件下NO3-都反应(2分)
①SO2+ 2Fe3++Ba2++2H2O="=" BaSO4↓+2Fe2++4H+(2分)
取少量B溶液于试管中,加入少量的酸性KMnO4溶液,紫色褪去则溶液中有Fe2+,然后用湿润的淀粉KI试纸靠近B导管末端,若不变蓝,说明NO3-没反应则证明观点2合理(3分)
②c(2分)
本题解析:(1)浓硫酸和亚硫酸钠反应生成SO2,方程式为Na2SO3+H2SO4(浓) = Na2SO4+ SO2↑+H2O。
(2)要排除空气对实验的干扰,则就需要排尽装置中的空气。可利用氮气来排尽装置中的空气,即打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。
(3)B中溶液显酸性,因此不可能是亚硫酸钡沉淀,只能是硫酸钡沉淀。这说明SO2被氧化生成了硫酸产生的,因此SO2具有还原性。
(4)根据观点2、3可知,观点1应是SO2和Fe3+、酸性条件下NO3-都反应。
①如果是②,则铁离子的还原产物是亚铁离子,所以方程式为O2+ 2Fe3++Ba2++2H2O==
BaSO4↓+2Fe2++4H+。要检验亚铁离子,可利用其还原性进行检验,即取少量B溶液于试管中,加入少量的酸性KMnO4溶液,紫色褪去则溶液中有Fe2+。如果NO3-氧化了SO2,则其还原产物是NO,NO具有氧化性,可以利用湿润的淀粉KI试纸,即用湿润的淀粉KI试纸靠近B导管末端,若不变蓝,说明NO3-没反应则证明观点2合理。
②为排除铁离子的干扰,可以选择不含铁离子的硝酸盐即可,所以答案选C。
本题难度:一般
2、实验题 某学生为探究钠与CO2的反应,利用如下装置进行实验。
(已知PdCl2能被CO还原得到黑色的Pd)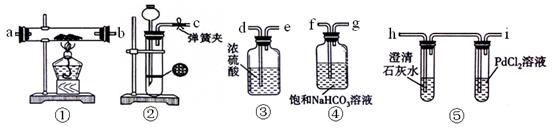
(1)请将上图各装置连接完整
?接?, ?接?, ?接?, ?接?。
(2)装置②制备CO2时具有随开随用,随关随停的功能。简述该装置随关随停的理由
?;
(3)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是?。
A.NaNO3溶液
B.CCl4
C.苯
D.稀硝酸
(4)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是?
?,当观察到?现象时才点燃酒精灯。此步操作的目的是?。
(5)反应过程中CO2足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
①装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体。?。
②装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留。?。
参考答案:(1)c接f,g接d,e接a(b),b(a)接h(3分)
(2)关闭弹簧夹后反应生成的气体增多,容器内压强增大,增大到一定程度后把反应液压回漏斗,使两反应物脱离接触从而停止反应(2分);
(3)ABD(2分)
(4)打开弹簧夹,让CO2充满整个装置(2分);装置⑤中澄清石灰水变浑浊(2分);排尽装置中空气,以免空气中O2、CO2、H2O干扰实验(2分)。
(5)①2Na+2CO2 Na2CO3+CO(2分)?②4Na+3CO2
Na2CO3+CO(2分)?②4Na+3CO2 2Na2CO3+C
2Na2CO3+C
本题解析:略
本题难度:一般
3、选择题 下列实验可达到实验目的的是:
①将 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
② 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备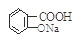 ?
?
③向CH3CH2Br中滴入AgNO3溶液以检验溴元素
④用溴水即可检验CH2=CH-CHO中的碳碳双键
A.只有①
B.只有①④
C.只有①③④
D.都不能
参考答案:A
本题解析:②NaHCO3会和-COOH反应,故错;③CH3CH2Br与AgNO3不反应,故错;④溴水还可以氧化-CHO,故错。故选A。
点评:本题考查了官能团的检验方法和现象分析、有机物的制备,关键是官能团检验时试剂的作用,三个官能团应逐一检验且不能相互影响。
本题难度:简单
4、实验题 (9分)下列有关化学实验的操作或说法中,正确的是(填字母序号)?。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可
C.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低。
D.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次。
E.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
F.向2mLl0%NaOH溶液中滴入2%CuSO4溶液的4—6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有红色沉淀出现。
参考答案:BDF
本题解析:略
本题难度:简单
5、实验题 (15分)某课外活动小组以胆矾为原料进行如下实验:
I、测定晶体中结晶水的含量:
测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨?②称量空坩埚和装有试样的坩埚的质量?③加热?④冷却?⑤称量?⑥重复③至⑤的操作?⑦根据实验数据计算硫酸铜结晶水的含量。
(1)第④步需要使用的仪器是?。
(2)判断晶体是否完全失水的方法是:?。
(3)根据实验数据计算得出硫酸铜结晶水的含量为5.3 ,估计造成误差的原因可能有?
?(提出两点可能的原因)。
II、用胆矾制得氧化铜固体来探究氧化铜的性质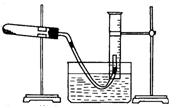
(1)取一定质量的氧化铜固体和一定质量的氯酸钾固体,混合均匀后用如图所示的装置加热制取氧气。为证明氧化铜在氯酸钾的分解反应中起催化剂的作用,在上述实验后还应该进行的实验操作是(按实验先后填写字母顺序)?。然后进一步证明该固体为氧化铜。
a.过滤? b.烘干? c.溶解? d.洗涤? e.称量
(2)但有同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你同意吗?若同意,要进行的另一个实验是?;若不同意,说明理由?。
参考答案:(15分)I.(1)干燥器;(2分)?
(2)连续两次称量的质量差不超过0.1g(3分)
(3)加热前所用坩埚未完全干燥; 加热时间过长导致CuSO4分解. (4分)
II.(1)cadbe;(3分)(2)另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率。(3分)
本题解析:略
本题难度:简单