时间:2021-06-11 05:55:47
1、选择题 下列各图中,表示正反应是放热反应的是 
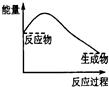


A B C D
参考答案:B
本题解析:在化学反应中,若反应物的总能量大于生成物的总能量,则该反应为放热反应,若反应物的总能量小于生成物的总能量,则该反应为吸热热反应。A表示的正反应为吸热反应,不能选;B表示表示的正反应为放热反应,故B为本题的答案;C表示的正反应不存在;D表示的正反应为吸热反应,不能选。
考点:化学反应中能量的变化
点评:本题考查了化学反应中能量的变化,该考点是高考常考的考点,本题难度不大,本题要掌握在化学反应中,若反应物的总能量大于生成物的总能量,则该反应为放热反应,若反应物的总能量小于生成物的总能量,则该反应为吸热热反应。
本题难度:一般
2、选择题 一定条件下发生反应A(g)+3B(g) = 2C(g);△H =" a" kJ·mol-1,现有1molA(g)和3molB(g)反应生成2molC(g),反应过程能量变化如图所示,
下列说法正确的是
A.该反应为放热反应,a=E1-E3。
B.该反应为放热反应, a=E2-E1
C.该反应为放热反应, a=△E1-△E2
D.该反应为吸热反应, a=△E2-△E1
参考答案:C
本题解析:
诗题分析:反应物能量比生成物能量高,所以反应为放热反应,反应热等于生成物的能量-反应物的能量,即a=E3-E1,反应热=反应物断键吸收的能量-生成物形成化学键释放的能量,a= a=△E1-△E2,所以选C。
考点:化学反应与能量
本题难度:一般
3、选择题 下列反应中,在高温下不能自发进行的是
A.MgCO3(s) ====MgO(s)+CO2(g)
B.2N2O5(g) =4NO2(g)+O2(g)
C.(NH4)2CO3(s) =NH3(g)+ NH4HCO3(s)
D.2CO(g) =2C(s)+O2(g)
参考答案:D
本题解析:根据△G=△H-T·△S可知,A、B、C中熵值都是增加的,所以高温下容易自发进行。D中熵值是减小的,且该反应是吸热反应,所以任何温度下都不是自发进行的,答案选D。
考点:考查反应自发性的判断
点评:该题是高考中的常见题型,属于基础性试题的考查,试题基础性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好△G=△H-T·△S,并能结合题意灵活运用即可。
本题难度:简单
4、选择题 中心原子采取sp2杂化的是? ( )
A.NH3
B.BCl3
C.PCl3
D.H2O
参考答案:B
本题解析:根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,则A、N原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp3杂化,故错误;B、B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp2杂化,故正确;C、P原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp3杂化,故错误;D、O原子杂化轨道数=δ键数+孤对电子对数=2+2=4,所以采取sp3杂化,故错误,答案选C。
本题难度:一般
5、选择题 下列有关能量的描述及热化学反应方程式表示不正确的是
A.表示氢气燃烧热的热化学方程式为:H2(g) + 1/2 O2(g) = H2O(l);ΔH= -258.8 kJ ?mol-1
B.化学上把在稀溶液中,酸与碱发生中和反应生成1mol水时的反应热称为中和热。中和热可以用量热计直接测量
C.已知C(石墨) +O2(g) = CO2(g) ΔH="-393.5" kJ ?mol-1;
CO(g) + 1/2 O2(g) = CO2(g) ΔH="-283.0" kJ ?mol-1
则C(石墨)+1/2O2 (g)="CO(g)" ΔH="-110.5" kJ ?mol-1
D.关于“盖斯定律:‘一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的’。”可以理解为“一个反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关”。
参考答案:B
本题解析:A、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示氢气燃烧热的热化学方程式为:H2(g) + 1/2 O2(g) = H2O(l);ΔH= -258.8 kJ ?mol-1,A正确;B、化学上把在稀溶液中,酸与碱发生中和反应生成1mol水时的反应热称为中和热。中和热并能用量热计直接测量,B错误;C、已知① C(石墨) +O2(g) = CO2(g) ΔH="-393.5" kJ ?mol-1;②CO(g) + 1/2 O2(g) = CO2(g) ΔH="-283.0" kJ ?mol-1,则根据盖斯定律可知①-②得到C(石墨)+1/2O2 (g)="CO(g)" ΔH="-110.5" kJ ?mol-1,C正确;D、关于“盖斯定律:‘一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的’。”可以理解为“一个反应的焓变只与反应体系的始态和终态有关,而与反应的途径无关”,D正确,答案选B。
考点:考查反应热的有关判断、盖斯定律的应用等
本题难度:一般