时间:2021-06-11 05:53:34
1、选择题 某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是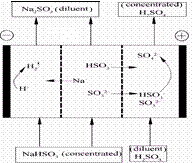
A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e—=H2↑
C.diluent和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
参考答案:C
本题解析:阴极区消耗氢离子,剩下亚硫酸根离子;阳极区消耗亚硫酸根离子剩下氢离子,并且生成硫酸根离子。所以阳极区会放出浓度更大的硫酸,阴极区会放出浓度变小的亚硫酸钠溶液。
本题难度:一般
2、选择题 下列有关工业生产的叙述中,不正确的是高温( )
A.硫酸工业中,在接触室安装热交换器是为了循环利用反应放出的热量
B.工业上用热还原法冶炼铝:Al2O3+CO═3CO2+2Al
C.在铁管上镀铜时,用铁管做电解池阴极,铜块做阳极
D.工业合成氨生产中,适当提高原料气中氮气的含量,可提高H2的转化率
参考答案:A、SO2转化为SO3放出热量,硫酸工业中,在接触室安装热交换器可以实现能量的循环利用,故A正确;
B、工业上金属铝的冶炼采用电解熔融的氧化铝的方法来获得,不能采用还原法,故B错误;
C、电镀装置中,镀件作阴极,镀层金属做阳极,在铁管上镀铜时,用铁管做电解池阴极,铜块做阳极,故C正确;
D、工业合成氨生产中,提高原料气中氮气的含量,会导致化学平衡正向移动,可提高H2的转化率,故D正确.
故选B.
本题解析:
本题难度:简单
3、选择题 下列说法不正确的是
A.纯锌与稀硫酸反应时,为加快速率可滴入少量硫酸铜溶液
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
参考答案:C
本题解析:A:通过形成锌铜原电池加快产生氢气的速率,正确
B:由△S>0,低温下△G=△H-T△S>0,可知,△H>0,正确
C:催化剂不能使平衡移动,故不能提高反应物的平衡转化率,不正确
D:正确
答案为C
本题难度:一般
4、选择题 下列反应不可用于设计原电池的是
A.NaOH+HCl = NaCl+H2O
B.2CH3OH+3O2 2CO2+4H2O
2CO2+4H2O
C.Zn+2HCl = ZnCl2+H2↑
D.4Al+3O2+6H2O = 4Al(OH)3
参考答案:A
本题解析:A选项由于没有发生自发氧化还原反应,B、C、D选项中都有自发的氧化还原反应,都可以设计成原电池。
考点:原电池的形成条件
点评:原电池的形成条件有以下几点:1、有电解质溶液;2、有两个活泼性不同的金属或非金属电极。3、闭合回路。4、能发生自发的氧化还原反应。
本题难度:简单
5、选择题 下图所示的装置中,有关说法不正确的是 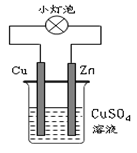
A.该装置实现化学能转变为电能
B.该装置中Cu2+向Zn电极移动
C.该装置外电路中电子由Zn棒转移到Cu棒
D.该装置中Zn棒上的电极反应为:Zn-2e-=Zn2+
参考答案:B
本题解析:该装置为原电池装置。原电池是将化学能转变为电能的装置,在原电池中。较活泼的金属做负极,不活泼的金属或非金属做正极。负极失去电子发生氧化反应,失去的电子转移到正极,使正极附近集聚很多的电子,电子带负电,故能吸引电解质溶液中的阳离子,阳离子在正极附近得到电子,发生还原反应。所以在这个原电池的装置图中,我们知道锌做负极,铜做正极。电子的流动方向是负极流向正极即电子应由锌极流向铜极。电解质溶液中的铜离子应是向铜极移动。所以B选项是错误的
考点:考查原电池的相关知识
本题难度:一般