时间:2021-06-11 05:46:29
1、填空题 (9分)早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式
?,盛水的铁锅与水面接触的一圈最易生锈。钢铁生锈的条件是?,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的?(填字母)。
A.耐腐蚀性
B.延展性
C.导热性
D.导电性
(2)设计从废水中回收硫酸亚铁固体和铜的实验方案如下:
金属X是?,
写出上述实验方案中有关反应的化学方程式
①?②?。
参考答案:(1)3CO+Fe2O3 2Fe+3CO2?潮湿空气(或与水、氧气接触)? B
2Fe+3CO2?潮湿空气(或与水、氧气接触)? B
(2)Fe? Fe+CuSO4=Cu+FeSO4? Fe+H2SO4=FeSO4+H2↑
本题解析:(1)CO具有还原性,能用来冶炼金属,方程式为3CO+Fe2O3 2Fe+3CO2。在潮湿的环境中钢铁容易发生腐蚀而生锈。加工成柔软的金属丝,是金属的延展性,答案选B。
2Fe+3CO2。在潮湿的环境中钢铁容易发生腐蚀而生锈。加工成柔软的金属丝,是金属的延展性,答案选B。
(2)要得到金属铜,在应该置换出铜,同时不能引入杂质,所以X是铁,方程式为Fe+CuSO4=Cu+FeSO4。铜和稀硫酸不反应,而铁可以,所以要除去过量的铁,可以用稀硫酸,方程式为Fe+H2SO4=FeSO4+H2↑。
本题难度:一般
2、填空题 I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是?;实验室在配制FeSO4溶液时常加入?以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化?。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是?。
②计算上述产品中FeSO4·7H2O的质量分数为?。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因?。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。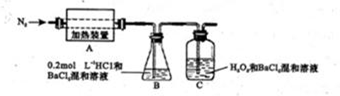
①A中固体充分加热较长时间后,通入氮气,目的是?。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为?。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为?(用离子方程式表示)
参考答案:(16分)I.(1)12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+(其它合理答案也给分)(2分);
铁粉(1分);取少量FeSO4溶液置于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO4溶液已被氧化,如不变红,则说明FeSO4溶液没有被氧化。(2分)
(2)①当最后一滴酸性高锰酸钾溶液滴入锥形瓶恰好出现浅紫红色,半分钟内不褪色,说明达到终点。(2分)?②97.54%(3分)
Ⅱ.(3)硫酸亚铁铵溶液中NH4+水解增大c(H+),抑制了上述氧化还原反应的进行。(2分)
(4)①使分解产生的气体在B和C中被吸收充分(1分)②溶液变混浊或出现白色沉淀(1分)
③SO2+H2O2+Ba2+=BaSO4↓+2H+或SO2+H2O2=SO42-+2H+、SO42-+Ba2+=BaSO4↓(2分)
本题解析: I.(1)亚铁离子具有还原性,极易被氧化生成铁离子,进而生成氢氧化铁沉淀,反应的离子方程式是12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+;由于亚铁离子极易被氧化生成铁离子,所以实验室在配制FeSO4溶液时常加入铁粉以防止其被氧化;亚铁离子易被氧化生成铁离子,可以通过检验铁离子来检验硫酸亚铁是否被氧化,即取少量FeSO4溶液置于试管中,加数滴KSCN溶液,如果溶液变红,则说明FeSO4溶液已被氧化,如不变红,则说明FeSO4溶液没有被氧化。
(2)①由于酸性高锰酸钾溶液显紫红色,所以用硫酸酸化的KMnO4滴定终点的标志是当最后一滴酸性高锰酸钾溶液滴入锥形瓶恰好出现浅紫红色,半分钟内不褪色,说明达到终点。
②消耗高锰酸钾的物质的量是0.01mol/L×0.04L=0.0004mol。反应中锰元素的化合价从+7价降低到+2价,得到5个电子,铁元素的化合价从+2价升高到+3价,失去1个电子,所以根据电子的得失守恒可知,25ml溶液中硫酸亚铁的物质的量是0.0004mol ×5=0.002mol。所以产品中FeSO4·7H2O的质量分数为 ×100%=97.54%。
×100%=97.54%。
Ⅱ.(3)由于硫酸亚铁铵在溶液中电离出的NH4+水解,溶液显酸性增大c(H+),抑制了上述氧化还原反应的进行,所以硫酸亚铁铵不易被氧化。
(4)①由于硫酸亚铁铵加热分解生成气体被装置B和C吸收,所以通入氮气的目的是使分解产生的气体在B和C中被吸收充分。
②三氧化硫溶于水生成硫酸,进而生成硫酸钡白色沉淀。所以若含有该气体,观察到的观象为溶液变混浊或出现白色沉淀。
③双氧水具有强氧化性,如果C中有白色沉淀生成,这说明反应中有SO2生成,SO2被双氧水氧化生成硫酸,进而生成硫酸钡白色沉淀,所以C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+或SO2+H2O2=SO42-+2H+、SO42-+Ba2+=BaSO4↓。42-检验;试剂的配制、滴定实验终点判断;物质含量的测定和计算;氧化还原反应方程式的书写等
本题难度:一般
3、选择题 把铜粉和铁粉的混合物,放入一定量的稀硝酸中,微热,反应完毕发现铜有剩余,则溶液中含有的阳离子是?
A.Cu2+、Fe2+
B.Cu2+、Fe2+、Fe3+
C.Cu2+、Fe3+
D.Fe3+
参考答案:A
本题解析:铜有剩余,说明硝酸已经反应完,可能发生的反应有:
Fe+4H++NO3-====Fe3++NO↑+2H2O
3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O
Fe+2Fe3+====3Fe2+
Cu+2Fe3+====2Fe2++Cu2+
从反应可知,当铜有剩余,溶液中Fe3+已消耗尽,铜跟Fe2+不能反应,所以溶液中的阳离子有Cu2+、Fe2+,选A。
本题难度:一般
4、选择题 为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是: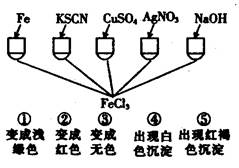
A.只有④
B.只有③
C.③和④均错
D.全部错误
参考答案:C
本题解析:①Fe与FeCl3溶液反应的离子方程式为:Fe + 2Fe3+ = 3Fe2+,溶液由棕黄色变为浅绿色,正确;②KSCN与FeCl3溶液反应的离子方程式为:Fe3+ + 3SCN- = Fe(SCN)3,溶液由棕黄色变为红色,正确;③硫酸铜与与FeCl3溶液不反应,溶液不会变为无色,错误;④硝酸银与FeCl3溶液反应的离子方程式为:Cl- + Ag+ =AgCl↓,产生白色沉淀,但不是Fe3+的性质,错误;⑤氢氧化钠与FeCl3溶液反应的离子方程式为:Fe3+ + 3OH- = Fe(OH)3↓,出现红褐色沉淀,正确;综上所述,选C。3+的性质及实验方案的评价。
本题难度:一般
5、简答题 工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: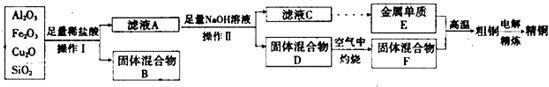
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)实验操作I的名称为?;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有?(填仪器名称).
(2)滤液A中铁元素的存在形式为?(填离子符号),生成该离子的离子方程式为?,检验滤液A中存在该离子的试剂为?(填试剂名称).
(3)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为?.
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=?.
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是?(填代号).
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤为:称取一定质量的样品→?→过滤、洗涤、干燥→称量剩余固体铜的质量.(填缺少的操作步骤,不必描述操作过程的细节)
参考答案:
本题解析:
本题难度:一般