时间:2021-06-11 05:46:07
1、选择题 下列离子方程式正确的是 ( )
A.向Mg( HC03)2溶液中加入过量的NaOH溶液:
Mg2+ +2 HC03- +20H-==MgC03↓ +C032-+ 2H20
B.向NH4 Al( S04)2溶液中滴人Ba( OH)2溶液使SO42-反应完全:
2Ba2++ 40H-十Al3++ 2 SO42-==2BaS04↓+Al02- +2H20
C.足够的C02通入饱和碳酸钠溶液中:C02+CO32-+ H20 ="2" HC03-
D.向Fe( N03)2溶液中加入稀盐酸:3Fe2+ +4H++N03-==3Fe3++ NO↑+2H20
参考答案:D
本题解析:A错,反应后Mg2+应生成氢氧化镁沉淀而不是碳酸镁沉淀,正确的离子方程式为Mg2+ +2 HC03- +40H-==Mg(OH)2↓ +2C032-+ 2H20;
;B错,正确离子方程式为:NH4++2Ba2++ 40H-十Al3++ 2 SO42-==2BaS04↓+Al(OH)3↓+NH3·H2O;
C错,正确的离子方程式为:C02+2Na++CO32-+ H20 ="2Na" HC03↓
本题难度:一般
2、实验题 (12分)利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下: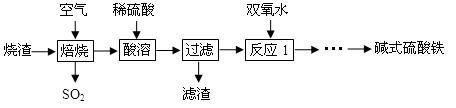
(1)SO2与过量NaOH溶液反应的离子方程式为 。
(2)滤渣的主要成分为 (填化学式)。
(3)反应1中加双氧水的目的是 。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920 g 样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300 g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。
根据以上实验数据计算碱式硫酸铁样品中的n(OH-): n(SO42-)(写出计算过程)
参考答案:(1)SO2+2OH-=SO32-+H2O;(2)SiO2;(3)将Fe2+氧化为Fe3+;(4)2:5。
本题解析:(1)当NaOH过量时,与酸性氧化物发生反应,产生正盐和水,SO2与过量NaOH溶液反应的离子方程式为SO2+2OH-=SO32-+H2O;(2)硫酸厂烧渣含铁的氧化物和少量FeS及SiO2,当焙烧时,会发生反应产生Fe2O3、SO2,向其中加入稀硫酸,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,原烧渣中的SiO2不能反应,也不能溶解,过滤除去,因此滤渣的主要成分为SiO2;在烧渣焙烧的过程中可能有部分FeS为完全煅烧,在酸溶时变为Fe2+留在溶液中,加入H2O2可以将溶液中的Fe2+氧化为Fe3+,得到的滤液中只含有阳离子Fe3+;(4)在1.6920 g 样品中含有的SO42-的物质的量是:n(SO42-)=2.3300 g÷233g/mol=0.01mol,向向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。该固体为Fe2O3,n(Fe2O3)=0.6400 g÷160g/mol=0.004mol,则n(Fe3+)=2n(Fe2O3)=0.008mol,由于任何化合物阳离子带的正电荷总数与阴离子带的负电荷总数相等。3 n(Fe3+)=n(OH-)+2 n(SO42-),所以n(OH-)="3" n(Fe3+)-2 n(SO42-)=3×0.008mol-2×0.01mol=0.004mol。则该碱式硫酸铁样品中的n(OH-): n(SO42-)= 0.004mol:0.01mol=2:5。
考点:考查物质制备流程的知识。主要包括离子方程式的书写、物质的成分的确定、物质的作用、化合物中微粒的个数比的确定。
本题难度:困难
3、选择题 下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是 ( )
A.在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应
2 NH3·H2O + SO2= 2NH4++ SO32-+H2O
B.FeCl2在空气中被氧化 4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH-
C.AlCl3溶液中通入过量的NH3:Al3++4NH3·H2O=AlO2-+4NH4+
D.FeBr2 (aq) 中通入少量Cl2 2Fe2+ + 4Br— + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl—
参考答案:A
本题解析:SO2用过量的氨水吸收生成硫酸铵,A正确。FeCl2在空气中被氧化变成铁锈,B错误。氢氧化铝不溶于弱碱氨水,C错误。FeBr2 (aq) 中通入少量Cl2先氧化亚铁离子,再氧化溴离子,D错误。
本题难度:困难
4、填空题 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。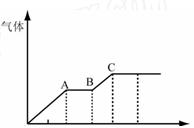
(1)写出下列各反应阶段所发生的离子反应式:
①写出O-A段发生的离子反应式: 。
②A-B段发生的离 子反应式: 。
子反应式: 。
③B-C段发生的离子反应式: 。
(2)分析A点溶液中主要存在那些离子: 。
(3)求原溶液中硫酸浓度是: 和硝酸的浓度是: 。
参考答案:(1)①Fe+4H++NO3-====Fe3++NO↑+2H2O
②2Fe3++Fe===3Fe2+
③Fe+2H+===Fe2++H2↑
(2)Fe3+、SO42-、H+
(4)4mol/L 2mol/L
本题解析:略
本题难度:一般
5、选择题 下列离子方程式中,正确的是 ( )
A.氧化亚铁和稀硝酸反应FeO+2H+===Fe2++H2O
B.硫酸铝溶液与足量烧碱:Al3++3OH-=Al(OH)3↓
C.氯化亚铁溶液中滴入氯水Cl2+2Fe2+===2Cl-+2Fe3+
D.金属铝投入NaOH溶液中2Al+2OH-+2H2O===2AlO+2H2↑
参考答案:CD
本题解析:A错,正确离子方程式为:3FeO+10H++NO3—===3Fe3++5H2O+NO;B错,正确离子方程式为:Al3++4OH-=AlO2—+2H2O;
本题难度:一般