时间:2021-06-11 05:42:52
1、填空题 (9分) 在一定体积的密闭容器中,进行如下可逆化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 ? CO2(g)+H2(g)的平衡常数K=?。
? CO2(g)+H2(g)的平衡常数K=?。 参考答案:(1)K=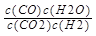 ?(2)B、C?(3)1.1
?(2)B、C?(3)1.1
本题解析:(1)根据化学平衡常数的定义:化学平衡常数指一定温度下,可能反应到达平衡是各生成物浓度幂之积与各反应物浓度幂之积的比值,结合反应CO2(g)+H2(g)?CO(g)+H2O(g)知,该反应的化学平衡常数表达式为K=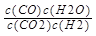 ;(2)A、该反应反应前后气体的物质的量不变,温度一定,容器中压强始终不变,不能说明到达平衡状态,错误;B、反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变,说明到达平衡状态,正确;C、v?(H2)正=v?(H2O)逆不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,正确;D、c(CO2)=c(CO)不能说明到达平衡,错误;选B、C;(3)CO(g)+H2O(g)
;(2)A、该反应反应前后气体的物质的量不变,温度一定,容器中压强始终不变,不能说明到达平衡状态,错误;B、反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变,说明到达平衡状态,正确;C、v?(H2)正=v?(H2O)逆不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,正确;D、c(CO2)=c(CO)不能说明到达平衡,错误;选B、C;(3)CO(g)+H2O(g) CO2(g)+H2(g)与题给反应互为逆反应,化学平衡常数K互为倒数,800℃时,平衡常数K=0.9,所以CO(g)+H2O(g)?CO2(g)+H2(g),化学平衡常数为1/0.9=1.1。
CO2(g)+H2(g)与题给反应互为逆反应,化学平衡常数K互为倒数,800℃时,平衡常数K=0.9,所以CO(g)+H2O(g)?CO2(g)+H2(g),化学平衡常数为1/0.9=1.1。
本题难度:一般
2、填空题 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g);△H<0
2SO3(g);△H<0
(1)该反应450℃时的平衡常数??500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0. 10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则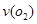 =?mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡?移动(填“向正反应方向”、“向逆反应方向” 或“不”)
=?mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡?移动(填“向正反应方向”、“向逆反应方向” 或“不”)
参考答案:大于 ; 0.036;向正反应方向
本题解析:正反应为放热反应,升高温度,平衡逆向进行,故生成物的浓度变小,反应物的浓度增大,因此450℃时的平衡常数大于500℃时的平衡常数;由v=Δc/Δt可得,v(SO3)=0.18mol÷0.5min÷5L="0.072" mol.L-1.min-1,故v(O2)=0.036mol.L-1.min-1;若继续通入0.20mol SO2和0.10mol O2,因容器体积不变,故压强增大,平衡向气体分子数减小的方向移动,则反应向正反应方向移动。
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。难度较大。
本题难度:一般
3、简答题 (14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: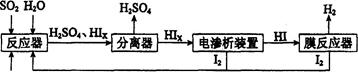
回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g) H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示: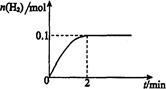
①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示: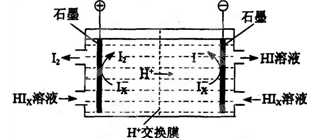
①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。
参考答案:(1)SO2+xI2+2H2O=H2SO4+2HIx;(2)①1/64,增大;②及时分离出H2,使平衡正向移动,提高HI的分解率;(3)①在阴极区发生反应:Ix-+(x-1)e-=xI-,且阳极区的H+通过交换膜进入阴极区,得以生成HI溶液;② 2HIx (x-1)I2+2HI;(4) I2
(x-1)I2+2HI;(4) I2
本题解析:(1)根据流程示意图可知:在反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx;(2)①该温度下,反应平衡常数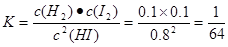 ;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx
;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx (x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
(x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
本题难度:一般
4、选择题 CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。其中一种途径是将CO2转化成有机物实现碳循环。此反应达平衡时平衡常数为: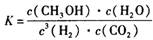 且温度升高,K值变小。下列说法正确的是
且温度升高,K值变小。下列说法正确的是
A.该反应的化学方程式为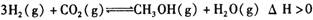
B.在恒温、恒容的密闭容器中,若混合气体的密度不再改变时,该反应一定达到平衡状态
C.平衡时,其他条件不变,使用催化剂有利用于CO2的转化
D.在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大
参考答案:D
本题解析:略
本题难度:一般
5、选择题 对于处于化学平衡状态的反应C(s) + H2O(g) 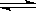 ?CO(g) + H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是 (? )
?CO(g) + H2(g) △H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是 (? )
A.增大C的量
B.降低压强
C.升温
D.使用合适的催化剂
参考答案:C
本题解析:由于反应是体积增大的,吸热的可逆反应,所以要提高H2O的转化率,BC都是向正反应方向移动,但B是降低反应速率,不正确,C正确。碳是固体,不影响平衡。催化剂能改变反应速率,但不能改变平衡状态,所以正确的答案选C。
本题难度:一般