时间:2021-06-11 05:39:59
1、选择题 设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
①标准状况下,20g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移NA个电子
③将2mol NO和1molO2混合后,体系中的分子总数为3NA
④常温下,0.4mol SiO2所含的共价健数目为1.6NA
⑤2mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4L的N2的共用电子对数为3 NA
A.2个
B.3个
C.4个
D.5个
参考答案:A
本题解析:①D即为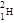 ,质子数、中子数、电子数均为1。1molD2O电子数为10mol,重水的摩尔质量为20g/mol,20g重水物质的量为1mol,①正确;2Fe2++H2O2+2H+=2Fe3++2H2O,1molFe2+失电子数为1mol,②错误;2mol NO和1molO2混合发生反应2NO+O2=2NO2,生成NO22mol,但2NO2
,质子数、中子数、电子数均为1。1molD2O电子数为10mol,重水的摩尔质量为20g/mol,20g重水物质的量为1mol,①正确;2Fe2++H2O2+2H+=2Fe3++2H2O,1molFe2+失电子数为1mol,②错误;2mol NO和1molO2混合发生反应2NO+O2=2NO2,生成NO22mol,但2NO2 N2O4,所以体系中气体物质的量在1~2mol之间,③错误;二氧化硅晶体中,1个硅原子与4个氧原子相连,1个氧原子与2个硅原子相连,1molSiO2晶体中有4molSi-O键,④正确;2mol·L-1碳酸钠溶液中Na+的物质的量浓度为4mol/L,⑤错误;氯气与水反应是可逆反应,由题给条件无法计算出氢离子数目,⑥错误;1mol氮分子中共价键数为3mol,共用电子对数为3mol,22.4氮气不一定是1mol,⑦错误。NA
N2O4,所以体系中气体物质的量在1~2mol之间,③错误;二氧化硅晶体中,1个硅原子与4个氧原子相连,1个氧原子与2个硅原子相连,1molSiO2晶体中有4molSi-O键,④正确;2mol·L-1碳酸钠溶液中Na+的物质的量浓度为4mol/L,⑤错误;氯气与水反应是可逆反应,由题给条件无法计算出氢离子数目,⑥错误;1mol氮分子中共价键数为3mol,共用电子对数为3mol,22.4氮气不一定是1mol,⑦错误。NA
点评:本题结合可逆反应、氧化还原反应、物质的状态、物质结构等考查阿伏伽德罗常数知识。
本题难度:一般
2、选择题 由H2、O2、CO2组成的混合气体的密度是同温同压下CH4密度的2倍,三种气体组分的物质的量之比不可能是:
A? 2 :3 :5? B? 2 :5 :5? C? 2 :1 :5? D? 2 :2 :7
参考答案:D
本题解析:混合气体的平均式量为16×2=32,而混合气体中氧气的式量恰好也为32,只需要H2和CO2的平均式量为32即可,由十字交叉法可知二者的物质的量之比为2:5,所以答案为D
本题难度:一般
3、选择题 N2、O2、CO2的混合气体通过足量的Na2O2,充分反应后,体积变成原体积的7/9(同温同压),则原混合气体中N2、O2、CO2物质的量之比不可能为 ( )
A.4∶3∶2
B.1∶4∶4
C.3∶2∶4
D.5∶5∶8
参考答案:A
本题解析:先假设原来气体总共体积为9V
2Na2O2+2CO2=2Na2CO3+O2,△V
2 1
x=4V 2V
那么N2和O2在混合物
本题难度:一般
4、选择题 “mg/dL”(1L=10dL)表示的物理量是
[?]
A.密度
B.物质的量浓度
C.摩尔质量
D.溶解度
参考答案:A
本题解析:
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数约是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
⑤2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.02 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
A.②③⑤⑥
B.①②③④⑤⑦
C.①③④⑤⑥
D.③④⑤⑥⑦
参考答案:A
本题解析:①错,12.4g白磷晶体的物质的量为0.1mol,而白磷的结构为空间正四面体形如图,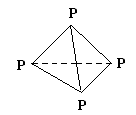 即含有的P-P键数约是0.6 NA;②错,电解精炼铜时转移了NA个电子,阳极溶解铜的质量小于32 g,因为阳极溶解的有铜、少量的锌、铁、镍等;③错,7.8 g Na2S和Na2O2的混合物中含有的阴离子数先等于0.1 NA;④正确,2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA,因该反应为可逆反应;⑤错,2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.01 NA ;⑥错,含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1 NA,因随反应的不断进行,浓硫酸会变成稀硫酸,稀硫酸与铜不反应;⑦正确,含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA,因为碳酸根离子要水解;
即含有的P-P键数约是0.6 NA;②错,电解精炼铜时转移了NA个电子,阳极溶解铜的质量小于32 g,因为阳极溶解的有铜、少量的锌、铁、镍等;③错,7.8 g Na2S和Na2O2的混合物中含有的阴离子数先等于0.1 NA;④正确,2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA,因该反应为可逆反应;⑤错,2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.01 NA ;⑥错,含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1 NA,因随反应的不断进行,浓硫酸会变成稀硫酸,稀硫酸与铜不反应;⑦正确,含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA,因为碳酸根离子要水解;
本题难度:困难