时间:2021-02-18 07:34:42
1、选择题 下列化学用语表示正确的是
A.Na2S的电子式: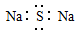
B.质子数为53,中子数为78的碘原子: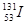
C.S2-的结构示意图: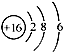
D.HOCH2COOH缩聚物的结构简式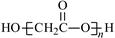
2、简答题 现有CH4、C2H4、C2H6、C3H6、C3H8五种有机物.
(1)同质量的以上物质完全燃烧时耗O2的量最多的是______;同状况、同体积、同物质的量的以上物质完全燃烧时耗O2的量最多的是______;同质量的以上物质完全燃烧时,生成的CO2最多的是______,生成水最多的是______.
(2)在120℃,1.01×105Pa时,以上气态烃和足量的O2点燃完全燃烧,相同条件下测得反应前后气体体积没有发生变化的是______.
3、选择题 下列化学用语表示正确的是?(?)
A.明矾的化学式KALSO4·12H2O
B.K的原子结构示意图
C.S2-的结构示意图
D.质子数为53,中子数为78的碳原子 I
I
4、选择题 下列说法正确的是
A.0.1 mol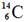 原子中含中子数为0.8×6.02×1023
原子中含中子数为0.8×6.02×1023
B.0.5 mol/L CuCl2溶液中含有的Cu2+数为0.5×6.02×1023
C.1 mol CO和 CO2混合物中,含有的碳原子数为2×6.02×1023
D.2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1×6.02×1023
5、选择题 0.2 molX2O72-与600mL1 mol/L Na2SO3溶液恰好完全反应,则反应后X的价态变为
A.0
B.+3
C.+2
D.+4
1、选择题 下列化学用语表示正确的是
A.Na2S的电子式: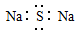
B.质子数为53,中子数为78的碘原子: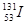
C.S2-的结构示意图: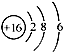
D.HOCH2COOH缩聚物的结构简式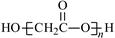
参考答案:B
本题解析:A、Na2S为离子化合物,错误;B、正确; C、硫离子为18电子,最外层为8电子,错误;D、酯化反应时羧基失去羟基,羟基失去氢,故为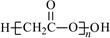 。
。
本题难度:一般
2、简答题 现有CH4、C2H4、C2H6、C3H6、C3H8五种有机物.
(1)同质量的以上物质完全燃烧时耗O2的量最多的是______;同状况、同体积、同物质的量的以上物质完全燃烧时耗O2的量最多的是______;同质量的以上物质完全燃烧时,生成的CO2最多的是______,生成水最多的是______.
(2)在120℃,1.01×105Pa时,以上气态烃和足量的O2点燃完全燃烧,相同条件下测得反应前后气体体积没有发生变化的是______.
参考答案:(1)同质量的烃CxHy,yx值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少.同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+y4的相对大小;
CH4、C2H4、C2H6、C3H6、C3H8五种有机物中,yx值分别为4、2、3、2、83,故CH4全燃烧时耗O2的量最多,生成的CO2最多的是C2H4、C3H6,生成水最多的是CH4,
CH4、C2H4、C2H6、C3H6、C3H8五种有机物中,x+y4的值分别为2、3、3.5、4.5、5,故同物质的量的以上物质完全燃烧时耗O2的量最多的是C3H8,
故答案为:CH4;C3H8;C2H4、C3H6;CH4;
(2)当温度大于100℃时,水为气态,当y=4时,燃烧前后体积不变,故相同条件下测得反应前后气体体积没有发生变化的是CH4、C2H4,
故答案为:CH4、C2H4.
本题解析:
本题难度:一般
3、选择题 下列化学用语表示正确的是?(?)
A.明矾的化学式KALSO4·12H2O
B.K的原子结构示意图
C.S2-的结构示意图
D.质子数为53,中子数为78的碳原子 I
I
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列说法正确的是
A.0.1 mol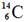 原子中含中子数为0.8×6.02×1023
原子中含中子数为0.8×6.02×1023
B.0.5 mol/L CuCl2溶液中含有的Cu2+数为0.5×6.02×1023
C.1 mol CO和 CO2混合物中,含有的碳原子数为2×6.02×1023
D.2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1×6.02×1023
参考答案:A
本题解析:略
本题难度:一般
5、选择题 0.2 molX2O72-与600mL1 mol/L Na2SO3溶液恰好完全反应,则反应后X的价态变为
A.0
B.+3
C.+2
D.+4
参考答案:B
本题解析:600mL1 mol/L Na2SO3溶液中Na2SO3的物质的量是0.6L×1 mol/L=0.6mol,亚硫酸钠被氧化为硫酸钠,失去电子的物质的量是0.6mol×2=1.2mol,设X元素反应后的价态是n,根据得失电子守恒,则0.2mol×2×(6-n)=1.2mol,解得n=3,答案选B。
考点:考查氧化还原反应得失电子守恒规律的应用
本题难度:一般