时间:2021-02-18 07:34:42
1、选择题 有关化学用语正确的是
A.乙烯的结构式:C2H4
B.四氯化碳的电子式: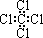
C.甲烷分子的比例模型:
D.苯的分子式: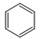
参考答案:C
本题解析:A不正确,乙烯的结构式是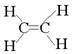 。B不正确,四氯化碳的电子式应该是
。B不正确,四氯化碳的电子式应该是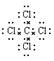 ;苯的分子式是C6H6,D不正确,答案选C。
;苯的分子式是C6H6,D不正确,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:一般
2、选择题 如图所示,四条直线分别表示钠、镁、铝、铁与足量Cl2反应时消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是( )
A.a
B.b
C.c
D.d
参考答案:C
本题解析:Na、Mg、Al、Fe与足量Cl2反应消耗等质量Cl2时,反应掉金属的质量由大到小的顺序为m(Na)>m(Fe)>m(Mg)>m(Al),所以选C。
本题难度:简单
3、选择题 下列生活中的化学现象与氧化还原知识有关的是
A.用食醋可以洗水垢(主要成分为CaCO3、Mg(OH)2)
B.蔗糖放在水中片刻后消失了
C.菜刀洗过后如果没擦干放置一段时间就会出现斑点
D.稀盐酸洒在大理石台面上产生大量气泡
参考答案:C
本题解析:A 发生的是复分解反应,与氧化还原知识无关
B蔗糖放在水中片刻后消失了,是因为蔗糖溶于水,是物理变化
C 菜刀上出现斑点,是生成了铁锈,发生了氧化还原反应
D 发生复分解反应,与氧化还原知识无关
故选C。
本题难度:一般
4、选择题 下列粒子不具有氧化性的是
A.Cl2
B.H+
C.Mg
D.CO2
参考答案:C
本题解析:在反应中得到电子,所含元素化合价降低的物质是氧化剂,氧化剂具有氧化性。氯气、氢离子和CO2中的碳元素均可以得到电子,做氧化剂,具有氧化性。金属镁在反应中只能失去电子,在反应中只能做还原剂,只具有还原性,而没有氧化性,因此正确的答案选C。
本题难度:简单
5、选择题 下列化学用语正确的是
A.HClO的电子式:
B.中子数为10的氧原子:
C.硝基苯的结构简式:
D.CH4分子的球棍模型:
参考答案:B
本题解析: 试题分析:A 在HClO分子中H与O形成一对共用电子对,O与Cl也有一对共用电子对。所以HClO的电子式:?。B.? B. O质子数是8,中子数是10,则质量数是18 ,所以该同位素原子的的符合是
试题分析:A 在HClO分子中H与O形成一对共用电子对,O与Cl也有一对共用电子对。所以HClO的电子式:?。B.? B. O质子数是8,中子数是10,则质量数是18 ,所以该同位素原子的的符合是 .?正确。 C. 在硝基苯中-NO2与苯环的C原子相结合。其结构简式为:
.?正确。 C. 在硝基苯中-NO2与苯环的C原子相结合。其结构简式为: 。错误。? D. 给的是比例模型,不是球棍模型。错误。
。错误。? D. 给的是比例模型,不是球棍模型。错误。
本题难度:一般