时间:2021-02-18 07:28:44
1、选择题 下列粒子不具有还原性的是 (? )
A.H+
B.Fe2+
C.I—
D.H2
参考答案:A
本题解析:凡是元素的价态处于最高价的就只有氧化性,而没有还原性,所以答案选A。
点评:还原性是指失去电子的性质,因而表现在化合价上,应该是升高的。所以凡是元素的价态处于最高价的就只有氧化性,处于最低价的就只有还原性,而处于中间价态既有氧化性也有还原性,据此可以鉴别。
本题难度:简单
2、选择题 化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是
A.乙烯的结构简式:CH2CH2
B.乙醇的结构式:CH3CH2OH
C.四氯化碳的电子式: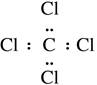
D.甲烷分子的比例模型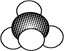
参考答案:D
本题解析:A不正确,乙烯的结构简式是CH2=CH2;乙醇的结构式是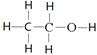 ,B不正确。C不正确,四氯化碳的电子式是
,B不正确。C不正确,四氯化碳的电子式是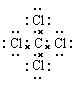 ,所以正确的答案选D。
,所以正确的答案选D。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:一般
3、选择题 氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关的推断中错误的是?
A.“另一种反应物”一定具有还原性
B.CuH既可做氧化剂也可做还原剂
C.CuH+Cl2=CuCl+HCl(燃烧)
D.CuH+HCl=CuCl+H2↑(常温)
参考答案:C
本题解析:A、根据化合价的变化判断,CuSO4做氧化剂、所以另一物质做还原剂,一定具有还原性,正确;B、CuH中的Cu处于+1价,可升可降,所以具有氧化性也具有还原性,正确;C、,Cl2氧化性很强,能够将+1价的铜氧化,所以,生成物不可能有亚铜,不会生成CuCl,错误;D、CuH中-1价的H与HCl中+1价的H发生氧化还原反应,生成H2,正确。
本题难度:一般
4、选择题 下列叙述正确是的
A.人工固氮的过程一定涉及到氧化还原反应
B.1mol氯气在反应中一定得到2mol电子
C.1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子
D.发生化学反应时,失去电子越多的金属原子,还原能力越强
参考答案:A
本题解析:A、游离态的氮转化为化合态氮的过程称为氮的固定,因此人工固氮的过程一定涉及到氧化还原反应,A正确;B、1 mol氯气在反应中不一定得到2mol电子,例如氯气与氢氧化钠溶液反应时,氯气既是氧化剂,也是还原剂,反应中转移1个电子,B不正确;C、钠在反应中化合价从0价升高到+1价,只能失去1个电子,所以1mol钠在足量氧气中燃烧生成Na2O2,失去1mol电子,C不正确;D、还原性强弱,与失去电子的多少无关系,只与失去电子的难易程度有关系,所以发生化学反应时,失去电子越多的金属原子,还原能力不一定越强,D不正确,答案选A。
本题难度:一般
5、选择题 等物质的量的Mg、Al、Zn、Fe分别与过量的稀硫酸反应,反应后产生氢气最多的金属是( )
A.Mg
B.Al
C.Zn
D.Fe
参考答案:因酸足量,金属均完全反应,设等物质的量的Mg、Al、Zn、Fe的物质的量都是1mol,
则Mg失去的电子数为1mol×(2-0)=2mol,
Al失去的电子数为1mol×(3-0)=3mol,
Zn失去的电子数为1mol×(2-0)=2mol,
Fe失去的电子数为1mol×(2-0)=2mol,
显然Al与足量酸反应时失去的电子数最多,则生成的氢气最多,
故选B.
本题解析:
本题难度:一般