时间:2021-02-18 07:24:50
1、实验题 (18分)某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
Ⅰ、用下列实验装置制取纯净干燥的氯气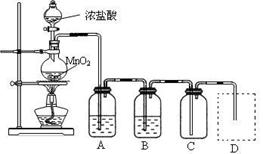
写出A、B中所盛放最佳化学试剂的名称?、?,画出虚线框内所需装置图并标明所需试剂的名称。
Ⅱ、某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:?;假设③:?。
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| ?实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | ? | 固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含______ |
2、实验题 “化学是以实验为基础的科学”。在实验中感知化学知识是学好化学的关键。请针对以下实验回答问题:
(1)【实验一】室温下,将a?g?Ba(OH)2·8H2O粉末和a/2?g?NH4Cl粉末置于锥形瓶中,并将锥形瓶置于滴有几滴水的玻璃片上,迅速搅拌,然后用带有玻璃导管的单孔橡胶塞塞紧瓶口,如下图所示。 
①该实验的现象是_________________。
②若将锥形瓶内物质加热产生的气体通入AlCl3溶液中,可观察到有白色沉淀生成,反应的离子方程式是________;分离出纯净的白色沉淀的主要操作有___________。
(2)【实验二】如下图所示,将适量的蔗糖放入小烧杯中,滴入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌。反应放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀。 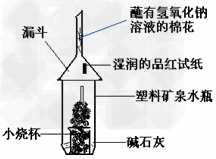
①蔗糖逐渐变黑,体现了浓硫酸的__________?性。
②湿润的品红试纸产生的现象是_________,产生该现象的物质是____________?,产生这一物质的化学方程式是___________,其中浓硫酸的作用是_____________。
④蘸有氢氧化钠溶液的棉花的作用是________________,发生反应的离子方程式是________________________。
(3)【实验三】如下图所示,将稀硝酸放入U型管中,把一端弯成螺旋状的Cu丝插到胶塞上。关闭分液漏斗活塞,塞好胶塞。 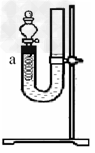
①反应一段时间后,可以看到a处液面下降,其他现象还有__________________。
②a处反应的离子方程式为_____________________?。
③检验a处产生气体的操作是_______________,现象和结论是________________?。
3、实验题 氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组长拟选用如下装置制备氢化钙。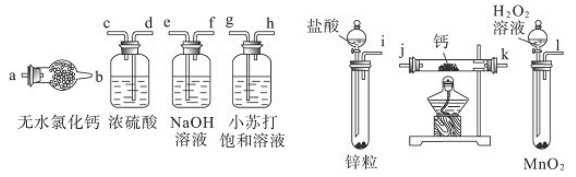
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________
②该同学的判断不正确,原因是_________________
(4)请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象___________。
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是____________。
4、选择题 利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A.BaCl2、HCl、石蕊溶液
B.BaCl2、HCl、品红溶液
C.AgNO3和HNO3溶液
D.AgNO3和BaCl2溶液
5、填空题 实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是 。回答以下问题:
。回答以下问题:
(1)A中加入硫酸溶液的仪器名称是:?。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是? ?。
(3)E装置的作用是? ?。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏? ?(填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为? ?。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是?。