时间:2021-02-18 07:20:55
1、选择题 甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ/mol
②CO(g)+2H2( g)=CH3OH(l) △H=-90.5 kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ/mol
下列说法不正确的是
[? ]
A.三个反应均为放热反应,故不需要加热就能进行
B.CO(g)+2H2(g)=CH3OH(g) △H>-90.5 kJ/mol
C.甲醇的燃烧热为764 kJ/mol
D.若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol
参考答案:A
本题解析:
本题难度:一般
2、填空题 把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)═CO2(g)△H1<0①
途径II:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0③
2H2(g)+O2(g)═2H2O(g)△H4<0④
请回答下列问题:
(1)途径I放出的热量______(填“大于”“等于”或“小于”)途径II放出的热量.
(2)△H1、△H2、△H3、△H4的数学关系式是______.
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量.其热化学方程式为______.
参考答案:(1)由盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,故答案为:等于;
(2)根据盖斯定律,反应1=反应2+反应3×12+反应4×12所以△H1=△H2+12(△H3+△H4),故答案为:△H1=△H2+12(△H3+△H4);
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量,即1mol炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量,热化学方程式为:C(s)+12O2(g)=CO(g)△H=-110.35kJ?mol-1,故答案为:C(s)+112O2(g)=CO(g)△H=-110.35kJ?mol-1.
本题解析:
本题难度:简单
3、选择题 已知:Fe2O3(s) + C(s) = CO2(g) + 2 Fe(s) ΔΗ=234.1 kJ·mol-1
C(s) + O2(g) = CO2(g) ΔΗ=-393.5 kJ·mol-1
则2 Fe(s)+ O2(g) = Fe2O3(s) 的ΔΗ 是
[? ]
A.-824.4 kJ·mol-1
B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1
D.-169.4 kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
4、推断题 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的
ZO两种氧化物。
(1)W位于元素周期表第________周期第___________族。W的气态氢化物稳定性比_________H2O(g) (填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是_________,Y的第一电离能比X的__________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_____________________。
(4)Fe(s)+O2(g)=FeO(s) △H=-272.0kJ·mol-1
2X(s)+O2(g)=X2O3(s) △H=-1675.7kJ·mol-1
X的单质和FeO反应的热化学方程式是_____________________________。
参考答案:(1)二;VA;弱
(2)1s22s22p63s23p4;大
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)3FeO(s)+2Al(s)==Al2O3(s)+3Fe(s) △H=-859.7kJ/mol
本题解析:
本题难度:困难
5、填空题 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1: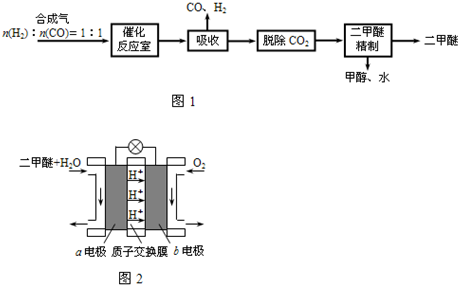
催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)催化反应室中的总反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g).
该反应的△H=______.催化反应室中采用300℃的反应温度,理由是______.
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol?CO、3mol?H2和2mol?CH3OH充入容积为2L的密闭容器中,此时反应将______(填“正向进行”、“逆向进行”或“处于平衡状态”).
(3)上述流程中二甲醚精制的实验操作名称为______.
(4)图2为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为______.
参考答案:(1)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产,采用300℃的反应温度,目的提高化学反应速率.
故答案为:-246.1kJ/mol;提高化学反应速率;
(2)该温度下将2mol?CO、3mol?H2和2mol?CH3OH充入容积为2L的密闭容器中,此时c(CO)=1mol/L,c(H2)=1.5mol/L,c(CH3OH)=1mol/L,浓度商Qc=11×1.52=0.44,大于平衡常数0.27,故反应向逆反应进行,故答案为:逆向进行;
(3)二甲醚、乙醇、水为互溶的液体,沸点不同,采取蒸馏的方法将二甲醚分离,故答案为:蒸馏;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+.
本题解析:
本题难度:简单