时间:2021-02-18 07:20:55
1、简答题 丙烷(C3H8)在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
已知:①2C3H8(g)+7O2(g)═6CO(g)+8H2O,△H1=-2741.8kJ/mol
②2CO(g)+O2(g)═2CO2(g),△H2=-566kJ/mol
(1)反应C3H8(g)+5O2(g)═3CO2(g)+4H2O?的△H=?.
(2)现有1mol?C3H8在不足量的氧气里燃烧,生成1mol?CO和2mol?CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是?.
a.体系中的压强不发生变化?b.v正(H2)=v正(CO)
c.混合气体的密度不再发生变化?d.CO2的浓度不再发生变化
②向平衡体系中充入少量CO则平衡常数?(填“增大”、“减小”或“不变”).
③若该反应达到平衡后,升高温度,则上述平衡向?反应方向移动(填“正”或“逆”).
2、选择题 甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71 kJ/mol
②CO(g)+2H2( g)=CH3OH(l) △H=-90.5 kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ/mol
下列说法不正确的是
[? ]
A.三个反应均为放热反应,故不需要加热就能进行
B.CO(g)+2H2(g)=CH3OH(g) △H>-90.5 kJ/mol
C.甲醇的燃烧热为764 kJ/mol
D.若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol
3、简答题 能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
I.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ?mol-1
CO(g)+1/2O2(g)=CO2(g)△H=bkJ?mol-1
C(石墨)+O2(g)=CO2(g)△H=ckJ?mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变△H=______kJ?mol-1.
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是______(填序号).
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应.
负极:______,
正极:______.
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂.ClO2是一种黄绿色气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下: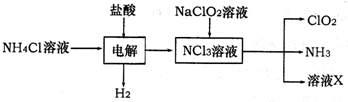
已知:电解过程中发生的反应为:
NH4Cl+2HCl
4、填空题 利用盖斯定律解答下列各小题
(1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:______.
(2)25℃、101kPa下:①2Na(s)+
| 1 2 |
5、选择题 已知下列热化学方程式:
Zn(S)+1/2O2(g)=ZnO(S)△H1;Hg(l)+1/2O2(g)=HgO(S)△H2;
则Zn(S)+HgO(S)=Hg(l)+ZnO(S)△H值为( ? )
A.△H2-△H1
B.△H2+△H1
C.△H1-△H2
D.-△H1-△H2