时间:2021-02-18 07:18:29
1、选择题 在无色透明的溶液中可以大量共存的离子组是
A.H+、K+、CO32-、NO3-
B.OH-、Cl-、Na+、NH4+
C.Mg2+、K+、Cl-、NO3-
D.Cu2+、NO3-、OH-、Cl-
2、选择题 下列各组离子在溶液中能大量共存的是(?)
①Ca2+、Na+、OH— 、NO3—?②K+、Fe3+ I—、Cl—?③NH4+、Na+、Cl—、CH3COO—
④K+、Mg2+、SO42—、CO32-?⑤Na+、S2—、SO42—、H+?⑥Na+、Cl—、ClO—、SO42—
A.①②③④⑤⑥
B.②⑤
C.②④⑥
D.③⑥
3、选择题 在指定环境中,下列各组离子一定可以大量共存的是(?)
A.使甲基橙变红的溶液中:Cr2O72-、Fe2+、SO42-、K+
B.无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4] 2+
C.加入过量氨水溶液仍然澄清的溶液中:Cu2+、Ag+、NO3-、NH4+
D.能使碘化钾淀粉试纸变蓝的溶液中: Na+、NH4+、S2-、Br-
4、选择题 下列溶液中,能大量共存的离子组是 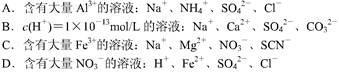
5、选择题 下列叙述正确的是( )
A.168O2和188O2互为同位素,性质相似
B.常温下,H+、NO3-、Fe2+可以大量共存
C.最外层有2个电子的原子都是金属原子
D.C(石墨)=C(金刚石)为吸热反应,所以石墨比金刚石稳定