时间:2021-02-18 07:18:29
1、选择题 现在有相同浓度的CH3COONa和NaClO溶液,两溶液中阴离子浓度的大小关系正确的是
A.前者大于后者
B.后者大于前者
C.两者相等
D.无法确定
参考答案:A
本题解析:
由两溶液中的电荷守恒式:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)和c(Na+)+c(H+)=c(ClO-)+c(OH-),由于次氯酸的酸性弱于醋酸,所以次氯酸根的水解大于醋酸根离子,所以次氯酸钠溶液的pH值大于醋酸钠,所以次氯酸钠溶液中的H+浓度小于醋酸钠溶液,所以由电荷守恒式得阴离子浓度和就等于阳离子浓度和,而两溶液中的钠离子浓度相等,所以H+浓度大的,则其阴离子浓度就大,所以应该是前者大于后者。
本题难度:一般
2、选择题 实验室欲配制一种仅含四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol/L,能达到此目的是( )
A.Na+、K+、Br-、NO3-
B.Ba2+、Mg2+、SO42-、Cl-
C.ClO-、I-、K+、Na+
D.H+、K+、Cl-、CO32-
参考答案:A.该组离子之间不反应,则能够共存,四种离子的浓度均为1mol/L,溶液为电中性,故A正确;
B.因Ba2+、SO42-能结合生成沉淀,则不能共存,故B错误;
C.因ClO-、I-能发生氧化还原反应,则离子不能共存,故C错误;
D.因H+、CO32-能结合生成水和气体,则不能共存,故D错误;
故选A.
本题解析:
本题难度:一般
3、选择题 下列各组离子:①Na+、ClO-、NO3-、H+,②K+、NH4+、HCO3-、OH-,③SO32-、SO42-、Cl-、OH-,④Fe3+、Cu2+、SO42-、Cl-,⑤H+、K+、Cl-、HSO3-,⑥Ca2+、Na+、SO42-、CO32-。在水溶液中能大量共存的是
[? ]
A.①
B.③④
C.②⑤
D.①④
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列各组中的离子,能在溶液中大量共存的是( )
A.Mg2+、SO42
参考答案:
本题解析:
本题难度:困难
5、选择题 某无色透明的酸性溶液中能大量共存的一组离子是
A.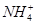 、
、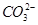 、Al3+、Cl-
、Al3+、Cl-
B.Na+、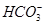 、K+、
、K+、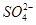
C.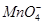 、K+、
、K+、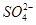 、Na+
、Na+
D.Mg2+、Na+、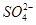 、
、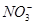
参考答案:D
本题解析:因为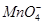 显示紫红色,而溶液是无色透明的,所以可以排除C选项;弱酸的酸根离子在酸性溶液中可以和H+反应生成相应的弱酸,所以
显示紫红色,而溶液是无色透明的,所以可以排除C选项;弱酸的酸根离子在酸性溶液中可以和H+反应生成相应的弱酸,所以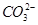 和H
和H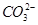 不能在此溶液中大量共存,其反应的离子方程式分别为
不能在此溶液中大量共存,其反应的离子方程式分别为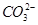 +2H+====H2O+CO2↑、
+2H+====H2O+CO2↑、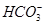 +H+====H2O+CO2↑,排除A和B选项。
+H+====H2O+CO2↑,排除A和B选项。
考点:离子反应
本题难度:一般