时间:2021-02-18 07:18:07
1、选择题 有关实验的叙述,正确的是
A.将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH是指上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
参考答案:D
本题解析:A项容量瓶不能用来直接盛装固体配置溶液,要将固体先在烧杯中溶解,冷却至室温转移到容量瓶中,A项错误;B项pH不能润湿,润湿后会改变待测夜的浓度,从而测定不准,B项错误;C项进行焰色反应时铂丝用浓盐酸洗涤并灼烧,如用NaOH洗涤会使NaOH粘附在铂丝上,干扰检验其它金属元素的焰色反应,C项错误;D项正确。
本题难度:一般
2、选择题 下列实验操作中,主要不是从安全因素考虑的是
A.酒精灯在不使用时,必须盖上灯帽
B.给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热
C.给试管里的液体加热时,试管口应略向上倾斜(约45℃),外壁干燥后再预热
D.用氢气还原氧化铜时,应先通一会氢气,再加热氧化铜
参考答案:A
本题解析:略
本题难度:简单
3、选择题 欲配制100 mL 1.0 mol/L Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4溶于100 mL水中
②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL
③将20 mL5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②
B.②③
C.①③
D.①②③
参考答案:B
本题解析:①错,因不知道溶液的体积,无法计算;②正确,100 mL 1.0 mol/L Na2SO4溶液的物质的量为0.1 mol,而32.2 g Na2SO4·10H2O的物质的量也为0.1mol,溶液体积为0.1L;③正确;20 mL5.0 mol/L Na2SO4溶液的物质的量为0.1 mol;
本题难度:简单
4、选择题 下列装置或操作正确的是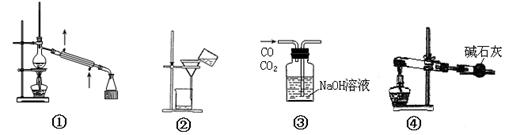
A.装置①常用于分离沸点不同,且彼此互溶的液态混合物
B.装置④可用于以CaCO3为原料实验室制备CO2
C.装置③可用于除去CO中混有的CO2气体
D.装置②常用于过滤操作
参考答案:A
本题解析:①是蒸馏装置,A正确;B不正确,实验室制取CO2,所用原料是大理石和盐酸,且不需要加热;C不正确,应该是长口进,短口出;D不正确,过滤时需要玻璃棒引流,答案选A。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以本部分主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:一般
5、选择题  下列实验操作正确的是(?)
下列实验操作正确的是(?)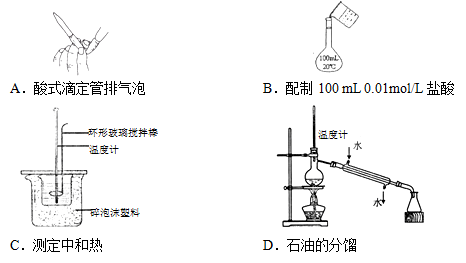
参考答案:C
本题解析:A 错,图为碱式滴定管,不是酸式滴定管
B 错 配置溶液要用玻璃棒引流
C 对
D 冷凝管的进出水的方向反了
本题难度:简单