时间:2021-02-18 07:09:17
1、选择题 下列各组热化学方程式程中,化学反应的△H前者大于后者的是
[? ]
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.①
B.④
C.②③④
D.①②③
参考答案:C
本题解析:
本题难度:一般
2、填空题 (共17分).Ⅰ(11分)、一无色透明的溶液做如下实验:
参考答案:
本题解析:
本题难度:困难
3、选择题 已知下列热化学方程式:
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.5kJ/mol
(2)2C2H6(g)+7O2(g?)═4CO2(g)+6H2O(l)△H=-3116.7kJ/mol
(3)C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1409.6kJ/mol
(4)2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2596.7kJ/mol
(5)C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2217.8kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出3037.6kJ热量,则下列哪些组合是不可能的( )
A.CH4和C2H2
B.C2H4和C3H8
C.C2H6和C3H8
D.C2H6和CH4
参考答案:AC
本题解析:
本题难度:简单
4、填空题 (14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g) +2NH3(g) (NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示: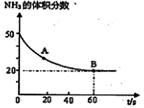
则A点的逆反应速率V(逆)(CO2) B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H=" +180.6" kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式 。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。
参考答案:(14分,每空2分) (1)< (1分)0.75 (2) 26 K=c2(NH3)×c(CO2)
(3)C(s)+2NO(g)=CO2(g)+N2(g) △H= -574.1kJ·mol-1
(4)2NO2 + CO32- = CO2 + NO2— +NO3— ; C (Na+)>C (NO3—)> C (NO2—)> C (OH—)> C (H+)
本题解析:(1)根据图像可知A点氨气的含量是变化的,这说明A点没有达到平衡状态,而B点达到平衡状态。A点到B点的氨气含量降低,这说明A点反应向正反应方向进行,正反应速率大于逆反应速率,则A点的逆反应速率V(逆)(CO2)小于B点的正反应速率V(正)(CO2)。根据图像可知起始时氨气和CO2的体积相等,设物质的量均是1mol,消耗氨气的物质的量是xmol,则生成水蒸气的物质的量是0.5xmol。平衡时氨气的含量是0.2,则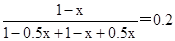 ,解得x=0.75,所以氨气的平衡转化率是0.75、
,解得x=0.75,所以氨气的平衡转化率是0.75、
(2)根据方程式可知生成的氨气和CO2的体积之比是2:1,则混合气体的平均相对分子质量是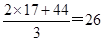 。由于只有生成物中有气体,则二者的体积之比是2:1,所以该反应的化学平衡常数的表达式为K=c2(NH3)×c(CO2)。
。由于只有生成物中有气体,则二者的体积之比是2:1,所以该反应的化学平衡常数的表达式为K=c2(NH3)×c(CO2)。
(3)已知:① N2(g)+O2(g)=2NO(g) △H=" +180.6" kJ·mol-1,② C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1,则根据盖斯定律可知①—②即可得到炭粉还原一氧化氮的热化学反应方程式为C(s)+2NO(g)=CO2(g)+N2(g) △H= -574.1kJ·mol-1。
(4)9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,NO2的物质的量是0.2mol,这说明氮元素的化合价部分升高到+5价,另外一半降低到+3价,则此反应的离子反应方程式为2NO2 + CO32- = CO2 + NO2— +NO3— ;若生成的CO2完全逸出,由于亚硝酸根水解,溶液显碱性,则所得溶液中的离子浓度大小关系为C (Na+)>C (NO3—)> C (NO2—)> C (OH—)> C (H+)。
考点:考查平衡状态计算、平衡常数、盖斯定律应用以及氧化还原反应计算和离子浓度大小比较等
本题难度:困难
5、选择题 已知下列热化学反应方程式:
① Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH =-24.8 kJ/mol
② Fe2O3(s)+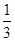 CO(g) =
CO(g) = 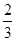 Fe3O4(s)+
Fe3O4(s)+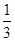 CO2(g) ΔH =-15.73 kJ/mol
CO2(g) ΔH =-15.73 kJ/mol
③ Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) ΔH =+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
A.-218 kJ/mol
B.-109 kJ/mol
C.+218 kJ/mol
D.+109 kJ/mol
参考答案:B
本题解析:根据题意可知需要计算热化学方程式FeO(s)+CO(g)=Fe(s)+CO2(g)的ΔH,根据盖斯定律,反应①×3-②×3-③×2可得6FeO(s)+6CO(g)=6Fe(s)+6CO2(g) ΔH≈-1 308 kJ·mol-1,所以FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-218 kJ·mol-1,14 gCO完全反应的ΔH为-109 kJ·mol-1,选B。
考点:考查盖斯定律的应用。
本题难度:一般