时间:2021-02-18 07:09:17
1、简答题 甲醇是一种燃料,也可以作为燃料电池的原料.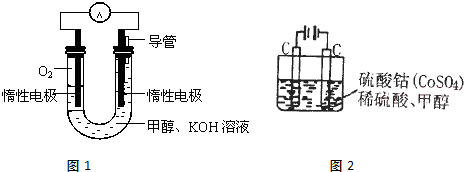
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6KJ/mol
②2CO?(g)+O2(g)=2CO2(g)△H2=-566.0KJ/mol
③H2O(g)=H2O(l)△H3=-44.0KJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______;
(2)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置,则电池正极的电极反应式:______,该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为______;
(3)甲醇对水质会造成一定的污染,用如图2所示的电化学法可消除这种污染,原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.则用该装置净化含10mol甲醇的水,转移电子数为______.
参考答案:(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO?(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
利用盖斯定律将①-②2+③可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
(2)碱性甲醇燃料电池中,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-+=CO32-+6H2O,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,该电池工作时,溶液中的OH-向负极移动,则总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:O2+2H2O+4e-=4OH-;负;2CH3OH+3O2+4OH-=2CO32-+6H2O;
(3)甲醇氧化成CO2,C元素的化合价升高+6价,则10mol甲醇失去60mol电子,转移的电子数为60NA,故答案为:60NA.
本题解析:
本题难度:一般
2、填空题 (1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。
①该反应的△H 0 (填“<”、“>”或“=”)。
②在温度容积不变的情况下,向该密闭容器再
增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
(3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
参考答案:(1)CO(g)+FeO(s)===Fe(s)+CO2(g) △H=-218.0kJ/mol
(2)① <; ② 增大(3)硝酸 抑制Ag+水解
②①④③
本题解析:(1)CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) △H的计算如下,将3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)加上Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) 乘以2,得到3Fe2O3(s)+ 3CO(g)=6FeO(s)+3CO2(g),化简得到Fe2O3(s)+ CO(g)=2eO(s)+CO2(g),
△H=1/3(-47.4kJ·mol-1+2×+640.5)=411.2kJ·mol-1,将Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)减去Fe2O3(s)+ CO(g)=2FeO(s)+CO2(g),化简得到2FeO(s)+2 CO(g)=2Fe(s)+2CO2(g) ,
△H=-24.8-411.2=-436kJ/mol,所以CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式为CO(g)+FeO(s)===Fe(s)+CO2(g) △H=-218.0kJ/mol;
(2)①由图可以知道,温度升高,CO的转化率减小,所以该反应为放热反应,故△H<0,②在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,相当于增大压强,反应向正方向移动,所以CO的转化率增大;
(3)由于银离子易水解,所以配制AgNO3溶液时通常需要向其中加入硝酸,目的是抑制Ag+水解,AgCl(s) Ag+(aq)+Cl-(aq),在①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液中,充分搅拌后,相同温度下Ag+浓度由大到小的顺序是②①④③。
Ag+(aq)+Cl-(aq),在①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液中,充分搅拌后,相同温度下Ag+浓度由大到小的顺序是②①④③。
考点:热化学方程式的书写,化学平衡
点评:本题考查了热化学方程式的书写,化学平衡,第一小题的计算比较繁杂,后面两个小题比较容易。
本题难度:困难
3、选择题 在298 K、100 kPa时,已知:
Cl2(g)+H2(g)===2HCl(g) ΔH1 2H2O(g)===2H2(g)+O2(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH2和ΔH1之间的关系正确的是
A.ΔH3=2ΔH1-ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=2ΔH1+ΔH2
D.ΔH3=ΔH2-ΔH1
参考答案:C
本题解析:根据盖斯定律,将Cl2(g)+H2(g)===2HCl(g) 的2倍与 2H2O(g)===2H2(g)+O2(g) 相加即可得到2Cl2(g)+2H2O(g)===4HCl(g)+O2(g),所以ΔH3=2ΔH1+ΔH2,答案选 C。
考点:考查盖斯定律的应用
本题难度:一般
4、填空题 能源是人类社会生活和社会发展的基础。请阅读以下材料,回答有关问题:
【小题1】在农村推广建造沼气池,不仅能有效地利用 能,还能为农业生产提供优良的肥料。已知标准状况下11.2L甲烷完全燃烧生成液态水时放出445kJ的热量,请写出甲烷燃烧的热化学方程式 。
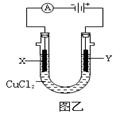
【小题2】某研究人员设计了如右图甲所示的甲烷燃料电池。则该燃料电池的负极是 (填a或b),正极反应为 。若以该电池为电源,石墨为电极电解CuCl2溶液(如右图乙所示),则Y极上发生的电极反应式为 。若电解过程中共消耗标准状况下甲烷0.56L,则理论上可析出金属铜 g。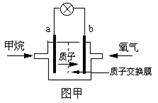
参考答案:
【小题1】生物质; CH4(g)+2O2(g)→CO2(g)+2H2O(l) △H=-890KJ/mol。
【小题2】a; O2+4H++4e-=2H2O ; 2Cl--2e-=Cl2 ↑ ; 6.4
本题解析:
【小题1】考查能量的相互转化以及热化学方程式的书写。有机物在一定条件下,通过微生物发酵作用可产生沼气,该过程利用的是生物质能。标准状况下11.2L甲烷是0.5mol,所以甲烷燃烧的热化学方程式为CH4(g)+2O2(g)→CO2(g)+2H2O(l) △H=-890KJ/mol。
【小题2】在燃料电池中负极是失去电子,发生氧化反应,所以甲烷在负极通入,所以a是负极,b是正极。根据装置图的结构可判断,正极电极反应式为2O2+8H++8e-=4H2O,负极反应式为CH4-8e-+2H2O=CO2+8H+。Y和电源的正极相连,作阳极,溶液中的阴离子氯离子在阳极放电,发生氧化反应生成氯气,电极反应式为2Cl--2e-=Cl2 ↑,阴极铜离子放电,发生还原反应生成铜,电极反应式为Cu2++2e-=Cu。0.56L甲烷失去的电子是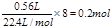 ,根据得失电子守恒可知,生成的铜是
,根据得失电子守恒可知,生成的铜是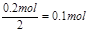 ,质量是0.1mol×64g/mol=6.4g。
,质量是0.1mol×64g/mol=6.4g。
本题难度:一般
5、选择题 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
参考答案:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
本题解析:由①×3-②-③×2得 6CO(g)+6FeO(s)=6Fe(s)+6CO2(g) △H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H="-218.0kJ/mol"
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
考点:本题考查的是用盖斯定律计算反应热。
本题难度:一般