时间:2021-02-18 07:05:43
1、填空题 下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示: 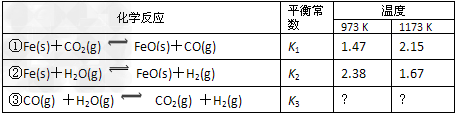
请回答:
(1)反应①是______(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式____________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有________(填写字母序号)。
A.缩小反应容器的容积? B.扩大反应容器的容积? C.升高温度
D.使用合适的催化剂? E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:? 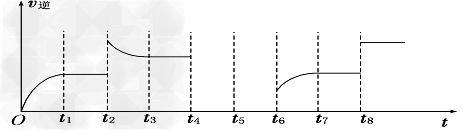
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时__________________;?t8时_________________。?
②若t4时降压,?t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
2、选择题 密闭容器中进行可xA(g)+yB(g)═zC(g)平衡时,测得A的浓度为0.50mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol/L,下列有大叙述不正确的是( )
A.平衡一定向右移动
B.B的转化率降低
C.x+y>z
D.C的体积分数降低
3、填空题 德国人哈伯在1905年发明的合成氨,其反应原理为:N2(g)+3H2(g)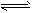 2NH3(g) 已知298K时:正反应的△H=-92.4KJ/mol,△S=-198.2J/mol/K。
2NH3(g) 已知298K时:正反应的△H=-92.4KJ/mol,△S=-198.2J/mol/K。
试回答下列问题:
(1)根据正反应的焓变和熵变判断298K下合成氨反应________(填“能”或“不能”)自发进行。
(2)加压平衡向正反应方向移动,该反应平衡常数K_______(填“变”或“不变”),当浓度商(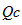 )
)
________化学平衡常数(Kc)(填“大于”、“等于”、“小于”)时,反应向右进行。
(3)在实际工业合成氨生产中采取的措施是__________(填序号)。
A、采用较低压强
B、采用700K左右的高温
C、用铁触媒作催化剂
D、将生成的氨液化并及时分离出来,未反应的和重新循环到合成塔中
4、选择题 在一固定体积的密闭容器中,有下列化学反应:CO(g)+H2O(g)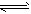 CO2(g)+H2(g) ,其化学平衡常数K和温度T的关系如下表
CO2(g)+H2(g) ,其化学平衡常数K和温度T的关系如下表
则下列说法错误的是
[? ]
A.其他条件不变,升高温度,CO的转化率变大
B.温度升高,正、逆反应速率都增大,在平衡移动的过程中气体压强始终保持不变
C.在反应建立平衡的过程中,混合气体的密度始终保持不变
D.若在某平衡状态时,c(CO2)×c(H2)= c(CO)×c(H2O),则此时的温度为830℃
5、填空题 牙齿表面由一层硬的、组成为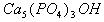 的物质保护着,它在唾液中存在下列平衡:
的物质保护着,它在唾液中存在下列平衡: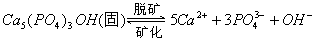 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是__________。 已知
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿受腐蚀,其原因是__________。 已知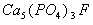 (固)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋牙的原因_________________________。 根据以上原理,请你提出一种其他促进矿化的办法:____________________。
(固)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋牙的原因_________________________。 根据以上原理,请你提出一种其他促进矿化的办法:____________________。